НАосмоза и преминаване на разтворител, от по-малко концентриран разтвор до по-концентриран разтвор, чрез полупропусклива мембрана, докато натискът, упражняван от разтвора върху мембраната, предотврати преминаването на разтворител. Този процес е предназначен да балансира концентрацията на разтвора.
Прочетете и вие: Разтворено вещество и разтворител
осмотичното налягане
НА осмотичното налягане и натиск, упражняван върху разтвора с по-голяма концентрация така че да не настъпи осмоза, тоест, така че разтворителят да не преминава през полупропускливата мембрана.
Осмотичното налягане се използва в процеси на обезсоляване на водата, принуждавайки процеса на обратна осмоза, което води до преминаване на разтворителя от по-концентрирания разтвор към по-слабо концентрирания. Ние наричаме този процес обратна осмоза. Вижте следното изображение, което сравнява двата процеса:
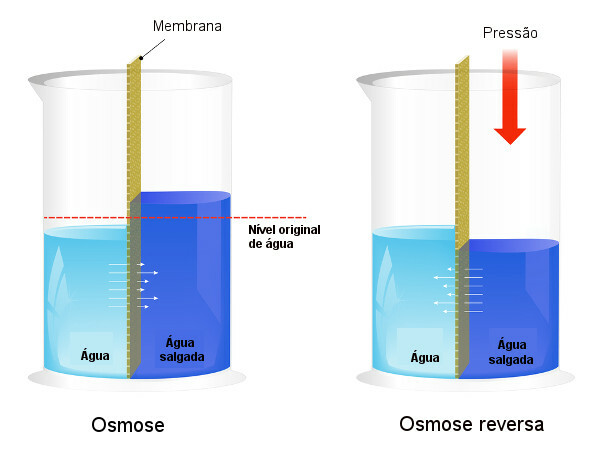
Имайте предвид, че при осмозата преминаването на разтворителя е в посока на най-концентрирания разтвор и че при обратна осмоза преминаването е в обратна посока поради приложеното налягане. За да научите повече по темата, прочетете нашия текст:
осмотичното налягане.знам повече: Обратна осмоза при обезсоляването на морската вода
уравнение за осмотично налягане
Осмотично налягане, представено с писмото pi (π) на решение, може да се изчисли чрез следното уравнение:
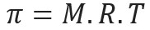
M = концентрация в mol / L
R = универсална константа на перфектни газове
T = абсолютна температура, в K
като другите колигативни свойства, осмотичното налягане зависи от концентрация на разтвора, тоест колкото по-голяма е концентрацията на разтвора, толкова по-голям е ефектът от осмозата върху разтворите и следователно е по-голямо осмотичното налягане.
Примери
Осмозата се появява в ежедневието ни по различно време. Можем да посочим примера на процес на осоляване на месо Към твоя запазване. Вие микроорганизми това би причинило разграждане на месото губят водаотвътре навън, който има концентрация на сол, което прави храната по-дълготрайна.
Поради солта също се случва листа от салата изсъхват за загуба на вода от вътрешността на техните клетки (вид по-малко концентриран) за закален разтвор във външната среда.
Осмозата също е важна, когато говорим за кръв човек. Ние казваме, че Червени клетки и кръвта е една изотонична среда, тоест те имат еднакво осмотично налягане, което позволява влизането и излизането на вода от клетката с лекота.
Когато обаче кръвта стане по-малко концентрирана, отколкото в червените кръвни клетки (хипотонична среда), преминаването на вода ще се случи по-лесно вътре в клетката, което я прави набъбват до избухване. Ако кръвта достигне концентрация, по-голяма от концентрацията на червените клетки (хипертонична среда), кръвните клетки изсъхват, тъй като те губят вода.

По същия принцип на консервиране на месото, опазване на плодоветев компотите от бонбони, които запазват храната поради висока концентрация на захар в разтвора.
Следват други примери, при които се появява осмоза:
- при покачване на сок в проводящите съдове на растението;
- в хемодиализа;
- при селективното преминаване на хранителни вещества в клетките на човешкото тяло.
За да разберете как се случва осмозата в животинската клетка, растителната клетка и други биологични проблеми, прочетете: Осмоза: какво е и как се случва в животинската и растителната клетка.
От Виктор Ферейра
Учител по химия



