Сред сложностите на атомното изследване е определянето на размера на атома или по-добре на атомен лъч. Това периодично свойство описва разстоянието от ядрото до най-външния електрон на неговите електронни нива. За да се определи, се извършва средно аритметично от разстоянието между ядрата на два атома, които образуват просто вещество, например.
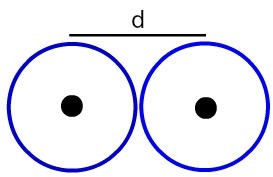
Представяне на разстоянието между две атомни ядра
Нека определим атомен радиус (RA) от атомите, илюстрирани на изображението. За да направите това, просто разделете разстоянието между ядрата на 2:
RA = д
2
О изследване на атомни лъчи е важно, защото благоприятства разбирането на някои физически събития (плътност, точка на синтез, точка на кипене и йонизационна енергия) и химикали (химически връзки), които възникват с атоми.
Чрез анализ на периодичната таблица можем да оценим дали атомът е по-голям или по-малък спрямо друг и по този начин определят дали има по-голяма или по-малка лекота при отстраняването на един или повече електрони от техните орбитали. НА
оценка и определяне на атомния радиус в периодичната таблица се извършва съгласно два основни критерия:а) Брой енергийни нива (семейства или групи / вертикални колони)
Знаем, че атомите могат да имат до седем енергийни нива (K, L, M, N, O, P, Q) и че всеки химичният елемент се намира в семейства или групи (вертикални колони) и в периоди (колони хоризонтално). Периодите показват броя на нивата, които има атомът на елемента, а семейството показва най-енергийното подниво на атома. В група или семейство химичните елементи се различават по количеството енергийни нива. Вижте таблицата по-долу:

Колкото по-голям е броят на енергийните нива на атома, толкова по-голям е атомният му радиус. Анализирайки горната таблица, може да се види, че франций има най-големия атом, тъй като има седем нива. Калиевият атом, от друга страна, има по-малък радиус, тъй като има четири енергийни нива. Следва сравнително представяне между франциевия атом и калиевия атом:
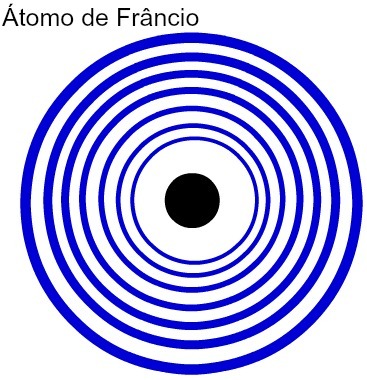
Представяне на седемте енергийни нива на атома Франций

Представяне на четирите енергийни нива на калиевия атом
Следващата диаграма представя как нарастването на атомния радиус се случва в същото семейство или група (вертикални колони) на периодичната таблица. Колкото по-голям е броят на нивата, толкова по-голям е радиусът, т.е. в периодичната таблица атомният радиус нараства отгоре надолу:
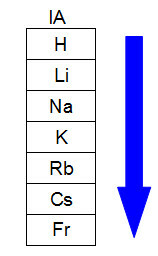
Представяне на това как атомният радиус се увеличава в семейството на периодичната таблица
б) Атомен номер (Z или брой протони) в същия период (хоризонтална колона)
Когато химическите елементи принадлежат към един и същи период, техните атоми имат еднакво количество енергийни нива, но количеството протони в техните ядра е различно. Следва поредица от елементи, принадлежащи към четвъртия период на периодичната таблица:
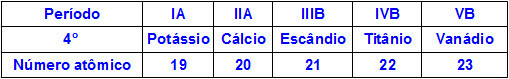
Всички атоми на елементите, представени в таблицата по-горе, имат четири енергийни нива, но всеки от тях има различно количество протони в ядрата си. Тъй като протоните вътре в ядрото упражняват привлекателна сила върху електроните, присъстващи в енергийните нива, колкото по-голямо е количеството протони в ядрото, толкова по-голямо е тяхното привличане към електроните. Резултатът е приближение на нивата към ядрото, намалявайки размера на атома.
↑Z = ↓ Атомен радиус
↓Z = ↑ Атомен радиус
По този начин можем да заявим, че атомният радиус на елемента калий е по-голям от този на ванадия поради по-малкия брой протони.
Следващата диаграма представя как атомният радиус се увеличава за същия период (хоризонтална линия). Колкото по-малък е атомният номер, толкова по-голям е радиусът, т.е. атомният радиус в таблицата нараства отдясно наляво
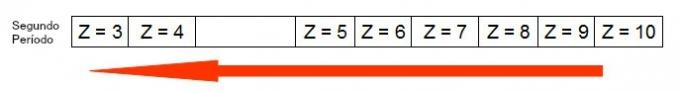
Представяне на това как атомният радиус се увеличава в период от периодичната таблица
От мен Диого Лопес Диа