междумолекулни сили те са начините, по които молекулите на съединенията (полярни или неполярни), образувани от ковалентни връзки, взаимодействат помежду си. Те са предложени през 1873 г. от холандския химик и физик Дидерик Ван дер Ваалс.
Според Ван дер Ваалс молекулите могат да взаимодействат по различен начин помежду си. Тези различни взаимодействия оказват голямо влияние върху точка на топене (MP) и точка на кипене (PE) на вещества. По този начин интензивността, с която молекулите взаимодействат, определя тяхната физическо състояние (твърдо, течно или газообразно).
Възприемането на съществуването на различни междумолекулни сили (взаимодействия) е просто, тъй като в природата можем да намерим една и съща материя в различни физични състояния. Сега се запознайте с трите вида междумолекулни сили, които могат да съществуват между веществата, образувани от ковалентни връзки:
→ Лондонски сили или индуцирани от дипол
Това е вид сила, която се появява между неполярни молекули, тоест молекули, които нямат полюси (положителни и отрицателни), тъй като електроните са равномерно разпределени в тяхната електросфера, както е на изображението по-долу:
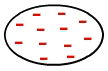
Равномерно разпределение на електроните в неполярна молекула
Въпреки това, в един момент електроните могат да се натрупват в дадена област на молекула, създавайки отрицателен и положителен полюс в нея. Тъй като тази молекула е близо до другата, този временен дипол в крайна сметка предизвиква електроните от другата молекула да се скупчат в единия край и така нататък:

Образуване на временен дипол в неполярна молекула
По този начин молекулите, които са били неполярни, сега имат индулен дипол.
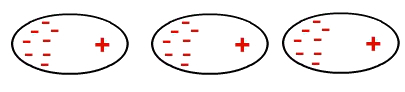
Взаимодействието на неполярни молекули възниква индуцирано
Някои примери за вещества, чиито молекули взаимодействат от този тип сила, са: въглероден диоксид (CO2), метан газ (СН4), етан газ (С2Н6) и водороден газ (Н2).
→ Постоянен дипол или дипол-дипол сила
Това е един вид междумолекулна сила, която възниква между тях полярни молекули (с изключение на тези, които имат елемента водород, пряко свързан с флуор, кислород или азот). Някои примери за вещества, чиито молекули взаимодействат чрез дипол-дипол, са солна киселина (HCl), серен диоксид (SO2), бромоводородна киселина (HBr) и циановодородна киселина (HCN).
Тъй като молекулите са полярни (те имат положителни и отрицателни полюси), те си взаимодействат така, че отрицателният полюс на единия се обединява с положителния полюс на другия и т.н.
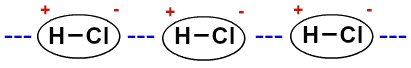
Представяне на постоянния дипол между молекулите на солната киселина
Поради наличието на дипол, тъй като молекулите са полярни, взаимодействието дипол-дипол е по-интензивно от индуцирания дипол.
→ водородни връзки
Това е вид междумолекулна сила, която се среща и в полярни молекули, но само ако водородният атом е пряко свързан с един от трите химични елемента (флуор, кислород и азот) плюс електроотрицателни от Периодичната система.
Някои примери за молекули, които взаимодействат чрез водородни връзки са: флуороводородна киселина (HF), амоняк (NH3) и вода (H2О).
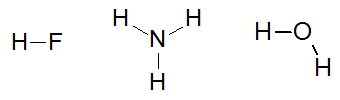
Структурни формули вещества флуороводородна киселина, амоняк и вода
Как възниква водородното свързване в молекули, чиято разлика в електроотрицателност между атомите е много голям, това е междумолекулна сила с висока интензивност (по-голяма от дипол-дипол и дипол индуциран).
Вижте представяне на това взаимодействие:
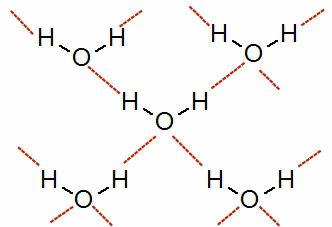
Представяне на водородните връзки между водните молекули
От мен Диого Лопес Диас
Източник: Бразилско училище - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-sao-forcas-intermoleculares.htm

