НА Закон за скоростта на реакцията свързва скоростта на химична трансформация с концентрациите на реагентите в количество вещество (mol / L), което може да се заяви, както следва:

Например, помислете за следната обща реакция:
aA + bB → cC + dD
Да кажем, че увеличаваме концентрацията на реагентите А и В, какво ще се случи със скоростта на реакцията? Е, тъй като количеството на реактивните частици ще се увеличава в същото пространство, ще има по-ефективни сблъсъци между тях, което ще доведе до увеличаване на скоростта на развитие на реакцията. Което означава, че ще увеличи скоростта ви.
Следователно скоростта на реакцията е право пропорционална на концентрацията на реагентите. Това обаче зависи и от температурата. Следователно имаме следното математическо уравнение, което представлява закона за скоростта на реакцията:

На какво:
v = скорост на реакцията;
k = константа, която зависи само от стойността на температурата;
α и β = експоненти, определени експериментално.
Едва когато реакцията е елементарна, тоест тя протича в една стъпка, степенните показатели са точно равни на коефициентите на балансираното химично уравнение:
v = k. [THE]The. [B]Б.. В други случаи обаче подходящата сила, до която трябва да се повиши концентрацията на всеки реагент, трябва да бъде определена експериментално.Законът за скоростта на реакциите се нарича много имена, ето няколко: Закон за масовото действие, уравнение на бързината, кинетичен закон на реакцията и закон на Гулдберг-Уааг.
Помислете за пример за прилагане на този закон:
Помислете за следната елементарна реакция:
2 НС1 (ж) → H2 (g) + Cl2 (g)
а) Напишете уравнението за скоростта на тази реакция;
б) Чрез експерименти в таблицата по-долу са отбелязани скоростта на тази реакция на разлагане на хлороводородния газ и концентрацията на този реагент при постоянна температура 25 ° C:
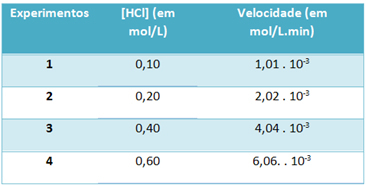
Въз основа на това определете характерната константа на скоростта на тази реакция при споменатата температура.
Резолюция:
The) v = k. [HCl]2
б) v = k. [HCl]2
k = __v___
[HCl]2
k = 1,01. 10-3 мол. L-1. мин-1
0,01 mol. L-1
k = 1,01. 10-1 мин-1
За да разрешите буквата „b“, можете да използвате данните на всеки от експериментите, че получената стойност ще бъде еднаква.
Но какво, ако реакцията не е елементарна? Как ще бъде възможно да се разрешат подобни въпроси при неелементарни реакции? За да разберете как, прочетете Закона за скоростта за неелементарни реакции.
От Дженифър Фогаса
Завършва химия
Източник: Бразилско училище - https://brasilescola.uol.com.br/quimica/lei-velocidade-das-reacoes-quimicas.htm
