THE батерия е система, в която протича окислително-редукционната реакция. В това устройство химическата енергия, произведена при спонтанната реакция, се преобразува в електрическа енергия.
Реакциите на окисление и редукция протичат едновременно в клетката. Когато един вид претърпи окисление, той отдава електрони на другия вид, който, след като ги получи, претърпява редукция.
Следователно този, който се подлага на окисление, е редуциращият агент, а този, който се подлага на редукция, е окислителят.
THE окисляване възниква, когато един вид губи електрони и се превръща в катион: A → A+ + и-.
THE намаляване възниква, когато даден вид получи електрони и стане електрически неутрален: B+ + и- → Б.
В химичните уравнения това трансфер на електрони се демонстрира чрез промяната на окислителното число (nox).
Вътре в клетките протичат редукционни реакции и електрическият ток възниква с миграцията на електрони от отрицателния към положителния полюс.

Как работи стекът?
един редокс реакция най-общо може да се представи с уравнението:
А + Б+ → А+ + Б
Където,
A: вещество, което се окислява, губи електрони, увеличава стойността си и е редукторът.
B: вещество, което претърпява редукция, получава електрони, намалява окисляването и е окислителят.
Вижте на следното изображение как може да бъде представен този процес.
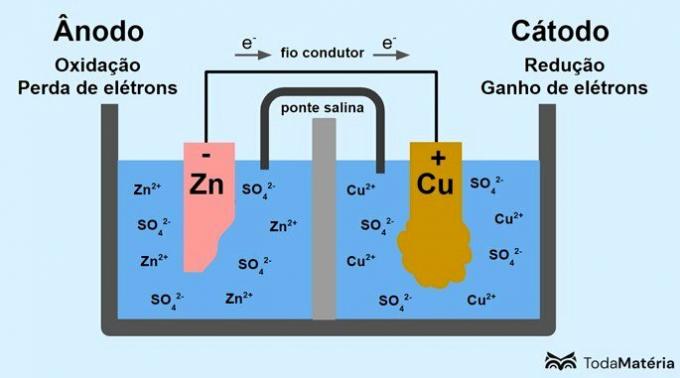
Системата, разделена на две полуклетки и образувана от два метални електрода, свързани външно с проводящ проводник, е разработена от Джон Фредерик Даниел (1790-1845) през 1836 г.
Батерията се състои от два електрода, свързани с проводник, и електролит, където са йоните. Електродът е твърдата проводяща повърхност, която позволява обмен на електрони.
анод: електрод, при който протича окисление. Това е и отрицателният полюс на батерията.
Катод: електрод, при който се получава редукция. Това е и положителният полюс на батерията.
В изображението по-горе металният цинк е анод и се подлага на окисляване. Металната мед е катод и претърпява редукция. Миграцията на електрони (e-) става от анода към катода през проводящия проводник.
Реакциите, които възникват в образната система са:
- анод (окисляване): Zn(с) → Zn2(тук) + 2е-
- Катод (намаляване): Cu2+(тук) + 2е- → задник(с)
- общо уравнение: Zn(с) + дупе2+(тук) → задник(с) + Zn2+(тук)
Цинкът е метал с по-голяма склонност да губи електрони и следователно в разтвора се образуват катиони. Цинковият електрод започва да се износва и губи маса, тъй като цинкът се освобождава в разтвора при образуването на Zn катиони2+.
Електроните от анода достигат до катода и при приемането им металните катиони се трансформират в метална мед, която се отлага върху електрода и увеличава масата му.
Солният мост е йонен ток, отговорен за циркулацията на йони в системата, за да я поддържа електрически неутрална.
Прочетете също за окислително число (nox).
видове батерии
В клетката тенденцията на химическите видове да получават или дават електрони се определя от редукционния потенциал.
Компонентът с най-висок редукционен потенциал има тенденция да претърпи редукция, тоест да получи електрони. Видът с най-нисък редукционен потенциал и, следователно, най-висок потенциал на окисление, има тенденция да пренася електрони.
Например при редокс реакцията Zn0(с) + дупе2+(тук) → задник0(с) + Zn2+(тук)
Цинкът окислява и отдава електрони, тъй като има редукционен потенциал E0 = -0,76 V, по-малко от редукционния потенциал на медта E0 = +0,34 V и следователно получава електрони и претърпява редукция.
Вижте по-долу за други примери за стекове.
Цинк и водородна купчина
Полуреакция на окисление: Zn(с) → Zn2+ + 2е- (И0 = -0,76 V)
Полуреакция на редукция: 2Н+(тук) + 2е- → З2(ж) (И0 =0,00V)
Глобално уравнение: Zn(с) + 2H+(тук) → Zn2+(тук) + З2(ж)
Представяне на стека:
Медна и водородна клетка
Полуреакция на окисление: H2(ж) → 2H+(тук) + 2е- (И0 = 0,00 V)
Полуреакция на редукция: Cu2+(тук) + 2е- → задник(с) (И0 = +0,34V)
Глобално уравнение: Cu2+(тук) + З2(ж) → 2H+(тук) + дупе(с)
Представяне на стека:
Получете повече знания по темата със съдържанието:
- електрохимия
- Електролиза
Библиографски справки
ФОНСЕКА, М. Р. М. Химия, 2. 1. изд. Сао Пауло: Атика, 2013 г.
SANTOS, W.L.P; МОЛ, Г.С. Гражданска химия, 3. 2. изд. Сао Пауло: Editora AJS, 2013 г.
УСБЕРКО, Дж. Свържете химия, 2: химия. - 2. изд. Сао Пауло: Сараива, 2014 г.



