НА Химическа кинетика е област, която изучава факторите, които влияят върху скоростта на развитие на химичните реакции, т.е. скоростта, с която те протичат. Около тази област има все повече изследвания, тъй като често искаме да ускорим някои реакции или да забавим други. Това е особено важно за индустриите и това изследване има важни технологични последици.
Но тъй като скоростта на реакцията може да варира във всеки интервал от време и от едно вещество до друго, обичайно е да се изчислява средна скорост на реакция.
Помислете за следната обща реакция, където коефициентите са малки букви, а реагентите и продуктите са представени с главни букви:
a A + b B → c C + d D
Ще бъде дадена средната скорост на тази реакция разделяне на средната скорост на реакция на някое от реагиращите вещества или средната скорост на образуване на който и да е от продуктите със съответния му коефициент в химичното уравнение. Това се дава от:
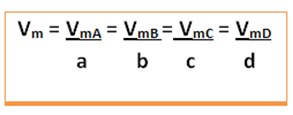
Например, помислете за реакцията на разпадане на водородния прекис:
2 часа2О2 (aq) → 2 ч2О(1) + 1 O2 (g)
Да кажем, че за 1 минута се образува 0,3 mol / L H2O и 0,15 mol / L от O2, докато 0,3 mol / L H се разлага2О2, тоест средните скорости на разлагане и образуване на тези вещества в реакцията са:
VmH2O2 = 0,3 mol / L. мин
VmH2O = 0,3 mol / L. мин
VmO2 = 0,15 mol / L. мин
Средната скорост на глобалната реакция ще бъде намерена, като се вземе една от тези стойности и се раздели на съответния коефициент в уравнението:
Vм = VmH2O2 = 0,3 mol / L. мин = 0,15 mol / L. мин
2 2
Vм = VmH2O = 0,3 mol / L. мин = 0,15 mol / L. мин
2 2
Vм = VmO2 = 0,15 mol / L. мин = 0,15 mol / L. мин
1 1
Имайте предвид, че трите стойности са равни, следователно скоростта на реакция е същата като функция на всеки реагент или продукт, в същия интервал от време.
Как обаче бяха открити стойностите на средните скорости на всяко от веществата, участващи в тези реакции?
Може да се изчисли разделяне на вариацията в концентрацията на веществото (реагент или продукт) на интервала от време. Ако ще определим средната скорост на един от реагенти от реакцията, ще трябва да поставим a отрицателен знак преди, или помислете за стойността на концентрацията в модул ||, тъй като, тъй като концентрацията на реагента намалява с времето, стойността на скоростта ще бъде отрицателна, но няма отрицателна скорост.
Не спирайте сега... Има още след рекламата;)

Например, разгледайте следната реакция на разлагане на озоновия газ (O3 (g)) в кислороден газ (O2 (g)):
2 O3 (g) → 3 O.2 (g)
Да кажем, че в балон имаше 10 мола газ от озон, но след 1 минута останаха само 4 мола; това означава, че 6 мола озон се превърнаха в кислороден газ. Така че имаме:
2 O3 (g) → 3 O.2 (g)
t = 0 min 2 mol / L 0 mol / L
формирани разходи
6 mol / L 9 mol / L
t = 1 мин. 4 mol / L 9 mol / L
Имайте предвид, че тъй като съотношението на реакцията е 2: 3, тогава ако са използвани 6 мола О3, Се образуват 9 mol от O2. И така, след 1 минута имаме следните средни скорости:
Vм = - ∆ [The3]
T
Vм = - ([O3финал - О3инициал])
TФинал - Tпървоначална
Vм = - ([4 - 10])
1– 0
Vм = 6 mol / L. мин→ В продължение на 1 минута 6 mol озон реагираха на всеки литър от системата.
Vм = ∆ [The2]
T
Vм = ([O2финал - О2инициал])
TФинал - Tпървоначална
Vм = ([9 - 0])
1– 0
Vм = 9 mol / L. мин→ За 1 минута във всеки литър от системата се образуват 9 мола кислород.
Това ни показва, че можем да изчислим средната скорост като функция на реагентите или като функция на продуктите.
Сега, ако искаме да изчислим средната скорост на тази глобална реакция, просто направете така, както показахме в началото: разделете всяка от тези скорости на съответните им коефициенти в химичното уравнение:
Vм = VmO3 = 6 mol / L. мин = 3 mol / L. мин
2 21
Vм = VmO2 = 9 mol / L. мин = 3 mol / L. мин
3 3
Vм = VmO3 = VmO2
23
От Дженифър Фогаса
Завършва химия
Искате ли да се позовавате на този текст в училище или академична работа? Виж:
FOGAÇA, Дженифър Роча Варгас. „Скорост на химичните реакции“; Бразилско училище. Наличен в: https://brasilescola.uol.com.br/quimica/velocidade-das-reacoes-quimicas.htm. Достъп на 27 юни 2021 г.



