В реакции на горене те присъстват в много аспекти от нашето ежедневие. Например, основните източници на производство на енергия са резултат от изгарянето или изгарянето на определени горива, като етанол, бензин, дървени въглища и други. Освен това енергията, от която се нуждаем, за да оцелеем и да вършим работа, е резултат от реакциите на горене, които протичат вътре в нашите клетки, когато „изгорим“ храната, която ядем.
Но какво е необходимо, за да има реакция на горене?
Необходими са три неща:
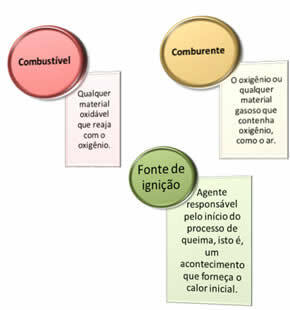
Тези три фактора съставляват огнен триъгълник, защото след като реакцията на горене започне, освободената енергия поддържа реакцията и й позволява да продължи, докато горивото, окислителят или топлината (освободената енергия) изчезнат. Това означава, че ще има a Верижна реакция.
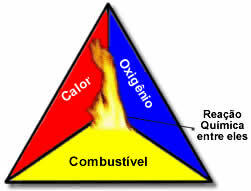
Например, ако някой хвърли запалена цигара в гора, ще има пожар (реакция на горене). В този случай, Буш това е гориво, О кислород във въздуха атмосферно е окислител това е цигара осветено беше източник на запалване. Това изгаряне ще продължи, докато не бъде елиминиран един от трите фактора. Ако пожарникарите хвърлят вода, топлината ще бъде елиминирана. Но дори и да не се направи нищо, за да се спре това изгаряне, то ще приключи в един момент, тоест когато горивото (гората) свърши.
Както вече споменахме, при тези реакции се отделя топлина, така че горенето е екзотермична реакция. Този тип реакция обаче е непълно изгаряне. За да разберете защо, вижте разликата между пълно и непълно изгаряне:
Пълно изгаряне:
Анализирайки органичните съединения като горива, ние трябва:
| THE пълно изгаряне това ще се случи, когато въглеродната верига е скъсана и всички въглеродни атоми във въглеродната верига са напълно окислени. |
| Вие образувани продукти от въглеводороди ще бъде CO2 (въглероден диоксид) и Х2О (Вода). |
Наблюдавайте пълното изгаряне на изооктана, който е един от компонентите на бензина.
° С8Х18(g) +25/2 О2 (ж) → 8 CO2(g) + 9 часа2О(1)
непълно изгаряне
| В този случай няма достатъчно окислител, тоест достатъчно кислород, за да изгори цялото гориво. |
| Така образуваните продукти са CO (въглероден окис) и Х2О. |
Наблюдавайте същото горене на изоктан, но сега непълно:
° С8Х18(g) + 17/2 О2(ж) → 8 CO (ж) + 9 часа2О(1)
Изгарянето на гори е пример, тъй като получените емисии се състоят от CO и определени вещества, като сажди (C), както и пепел и други прости и сложни органични съединения. Азотният оксид, озон и алдехиди също могат да се образуват в резултат на вторични реакции поради наличието на други компоненти във въздуха.
° С8Х18(g) + 9/2 О2 (ж) → 8C (ж) + 9 часа2О(1)
От Дженифър Фогаса
Завършил химия
Училищен отбор на Бразилия
Източник: Бразилско училище - https://brasilescola.uol.com.br/quimica/combustao-completa-incompleta.htm

