Основната отличителна черта на редокс реакциите е, че едновременно един химически вид губи електрони (чрез окисляване), а друг получава електрони (чрез редукция).
Въпреки това, при определени реакции е възможно да се наблюдава, че има не само окисление и/или редукция. По-долу е даден пример:
SnS + HCl + HNO3 → SnCl4 + S + NO + H2О
Изчислявайки числата на окисление (Nox) на всички атоми в тази реакция, както се преподава в текста „Определяне на окислителното число (Nox)“, имаме:
+2 -2 +1 -1 +1 +5 -2 +4 -1 0 +2 -2 +1 -2
SnS + HCl + HNO3 → SnCl4 + S + NO + H2О
Да проверим сега коивещества претърпяха вариации в техните Nox и следователно, които се окисляват и редуцират:
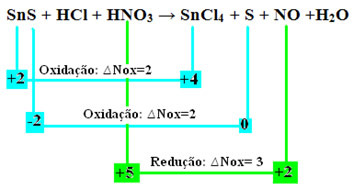
Имайте предвид, че са настъпили две окисления. И така, в такъв случай, как да балансираме химическото уравнение?
Едно важно нещо, което трябва да имате предвид, което се отнася за всички редокс реакции, е, че броят на отдадените електрони винаги трябва да е равен на броя на получените електрони.
Ето защо, за да балансирате този тип реакция, следвайте същите правила, установени в текста "
Редокс балансиране“, обаче само с една промяна: определянето на вариацията на Nox (∆Nox) на видовете, генерирали двете окисления (SnS), ще бъде сумата от двете ∆Nox, което ще ни даде общата стойност на загубените електрони:- SnS: ∆Общ Nox = (∆Nox SnCl4) + (∆Nox S)
SnS: ∆Общо NOx = 2 + 2 = 4
- HNO3: ∆Nox = 3
И така, можем да продължим със следните стъпки за балансиране:
- SnS: ∆Общ NOx = 4 → 4 ще бъде коефициентът на HNO3;
- HNO3: ∆Nox = 3 → 3 ще бъде коефициентът на SnS.
3 SnS + HCl + 4 HNO3 → SnCl4 + S + NO + H2О
Продължаване на балансирането чрез пробен метод:
- Тъй като имате 3 Sn и 3 S в 1-ви член, това също ще бъдат вашите коефициенти във 2-ри член:
3 SnS + HCl + 4 HNO3 → 3 SnCl4 + 3 Y+NO+H2О
- С това 2-ри член остана с 12 Cl (3. 4 = 12), така че 12 ще бъде коефициентът на веществото, в което Cl се намира в 1-ви член, който е HCl:
3 SnS + 12 HCl + 4 HNO3 → 3 SnCl4 + 3 S + NO +H2О
- Сега имаме 16 H в 1-ви член (12 + 4 = 16), следователно коефициентът на H2O ще бъде равно на 8, защото 8, умножено по водородния индекс, който е 2, дава 16:
3 SnS + 12 HCl + 4 HNO3 → 3 SnCl4 + 3 S + NO +8Х2О
- Освен това в 1-ви член също има 4 N, така че 4 също ще бъде коефициентът на N във 2-ри член:
3 SnS + 12 HCl + 4 HNO3 → 3 SnCl4 + 3 S + 4 NO +8 H2О
Имайте предвид, че количеството кислород в 1-ви крайник (3. 4 = 12) е равно на общото количество на този елемент във 2-ри крайник (4 + 8 = 12). Така че реакцията е балансирана.
От Дженифър Фогаса
Завършил химия
Източник: Бразилско училище - https://brasilescola.uol.com.br/quimica/reacoes-com-mais-uma-oxidacao-ou-reducao.htm


