Сред междумолекулните сили, индуцирани диполно-индуцирани диполни сили те са единствените, които не са изследвани от холандския физик Йоханес Дидерик Ван дер Ваалс (1837-1923). Те са изяснени от немския физик Фриц Волфганг Лондон (1900-1954), така че тези сили се наричат още лондонските сили или лондонските дисперсионни сили. Друго име, дадено на тези сили е моментен дипол-индуциран дипол.
Този вид сила възниква в неполярни вещества, като H2, O2, F2, Cl2, CO2, CH4 и C2H6, наред с други. И те могат да се появят и между атоми на благороден газ, когато се приближават, причинявайки отблъскване между техните електросфери. По този начин електроните се натрупват от определена страна, която е отрицателно поляризирана, а противоположната страна положително, поради дефицита на отрицателен заряд.
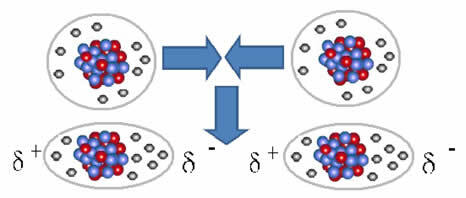
Неполярните молекули могат да преминат от газообразно състояние – в което са много далеч една от друга и няма взаимодействие, тъй като няма полюси – в течно и твърдо състояние. В тези агрегатни състояния молекулите са по-близо и електронното привличане или отблъскване между техните електрони и ядрата могат да доведат до деформация на техните електронни облаци, за момент, възникващи положителни и отрицателни полюси временна.
Моментните диполи могат да предизвикат поляризация на съседни молекули, което води до привличащи сили.
Тази индукция също може да възникне. между различни молекули и като цяло тези сили са по-слаби по интензитет отколкото якостта на дипол-диполната и водородната връзка. Следователно твърдите вещества с тази сила на взаимодействие, като сух лед (въглероден диоксид - CO2) и йод (I2), които са в твърдо състояние, са сублимни (преминават в газообразно състояние); защото енергията, необходима за нарушаване на техните взаимодействия, е малка.
Пример за междумолекулни сили между полярни и неполярни молекули е между кислороден газ (неполярна) и вода (полярна). Оказва се, че отрицателният край на водата се приближава до O2, като се отблъсква и по този начин електронният облак на неполярната молекула се отдалечава. След това кислородът е моментално поляризиран и започва да взаимодейства с водата, разтваряйки се в нея.
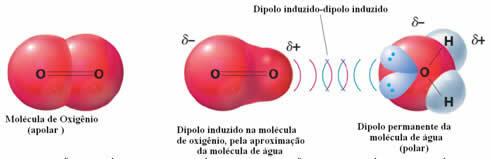
Тъй като тези сили са слаби, разтворимостта на този газ във вода е малка. Въпреки това присъствието му е от съществено значение за запазване на живота на различни водни организми.
Тази сила на взаимодействие се среща и в природата, осигурявайки прилепване между лапите на геконите и повърхността, по която те ходят. Ето защо те могат да ходят по стени и тавани, без да падат или залепват.
От Дженифър Фогаса
Завършил химия
Училищен отбор на Бразилия
Източник: Бразилско училище - https://brasilescola.uol.com.br/quimica/forcas-dipolo-induzido-dipolo-induzido-ou-dispersao-london.htm