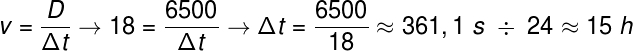Сулфатите са йонни съединения, които съдържат анион SO42-, който се нарича сулфатен анион.
Сярата е елемент от семейството 16 или VI-A, което означава, че има 6 електрона във валентната си обвивка. Според правилото на октета, ще трябва да получи още 2 електрона, за да има 8 електрона в последната електронна обвивка и по този начин да бъде стабилен. Но сярата претърпява разширяване на октет, тъй като е елемент, разположен в третия период от таблицата Периодичен, като е относително голям, което му позволява да побере повече от осем електрона към него наоколо.
По този начин, както може да се види по-долу, нивото на валентност на сярата се разширява до общо 12 електрона. Но два кислородни атома все още не са стабилни, всеки със седем електрона във валентната обвивка, като по този начин трябва да получи още един електрон за стабилизиране. Поради тази причина зарядът на всеки от тези два атома е -1, което води до общ заряд за аниона от -2:

Сулфатният анион може да идва от сярна киселина (Н2САМО4 (aq)) показано по-долу:

Сярната киселина реагира с някаква основа в неутрализираща реакция, образувайки неорганична сол, която е нашият сулфат, а също и вода:
Обща реакция: сярна киселина + основа → Сол (сулфат) + вода
З.2САМО4 + 2 ° Со →° С2САМО4+ 2 Н2О
Вижте пример по-долу, където се образува калиев сулфат:
З.2САМО4 + 2 КОН →К2САМО4+ 2 Н2О
Имайте предвид, че номенклатурата на сулфат се прави просто по правилото: сулфат + име на елемента, прикрепен към него. В допълнение, формулите за сулфати се правят чрез замяна на заряда на всеки йон за индекса на елемента, като индексът „1“ не трябва да се записва:
Примери:
В+1 САМО42- → В2САМО4→ натриев сулфат
mg+2 САМО42- → MgSO44→ магнезиев сулфат
Тук+2 САМО42- → Дело4→ калциев сулфат
Ба+2 САМО42- → BASO4→ бариев сулфат
Ал+3 САМО42- → Ал2(САМО4)3→ алуминиев сулфат
Солите, съдържащи сулфатния йон, обикновено са разтворими във вода, като изключенията са четири: калциев сулфат (CaSO4), стронциев сулфат (SrSO4), бариев сулфат (BaSO4) и оловен сулфат (PbSO4). Това е така, защото между тези катиони има висока свързваща енергия (Ca2+сър2+, Ба2+ и Pb2+) и сулфат, тъй като всички те имат +2 заряд, а сулфатният анион има -2 заряд. По този начин прекъсването на тази връзка става по-трудно.
Сулфатите се намират под формата на кристални решетки, поради привличането, което противоположните заряди упражняват един върху друг, както е показано по-долу в случая на меден сулфат (CuSO4):

Сулфатите се срещат в природата главно под формата на минерали. Вижте няколко примера:
барит → бариев сулфат;
Гипс → калциев сулфат;
Целестит → стронциев сулфат;
anglesiДобре → оловен сулфат;
Glauberite → двоен калций и натриев сулфат: CaNa2(САМО4)2;
Калиев стипца (калинит) → хидратиран двоен калиев алуминиев сулфат: KAl (SO4) 2.11H2О
Сред основните сулфати в ежедневието имаме калциев сулфат, който в безводна форма (без вода) се използва при производството на училищна креда. Когато е под формата на дихидрат, (CaSO4 .2ч2О), той е известен като гипс и е по-богат. При нагряване образува калциев сулфат хемихидрат (CaSO4. ½З.2O), което е мазилка, използвана в ортопедията, зъбните форми, гражданското строителство и боите.

Друга важна сол е sмагнезиев сулфат (MgSO44), известен като sгорчив ал или Epsom сол, която има слабително действие и се използва за масаж и релаксиращи вани.

От Дженифър Фогаса
Завършва химия