Законът на Хес е създаден от швейцарския химик Жермен Х. Хес (1802-1850), който се смята за един от основателите на термохимията. Неговият закон казва:

Тоест, ΔH зависи само от енталпийните стойности на реагентите и продуктите, както е в израза:
| ΔH = ΔHреагенти + ΔHпродукти |
Например, помислете за реакцията, при която 1 мол вода (H2O) се трансформира във вода в газообразно състояние. Тази реакция се извършва два пъти; ние обаче избрахме различни пътища:
(1-во) Беше извършено в една стъпка:
Н2О(1) → H2О(v) ΔH = +44 kJ
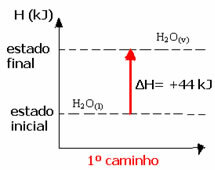
(2-ри) Той се проведе на два етапа:
1-ва стъпка: H2О(1) → H2 (g) + ½2 (g) ΔH = +286 kJ
2-ри етап: Н2 (g) + ½2 (g) → H2О(v) ΔH = -242 kJ
Н2О(1) → H2О(v) ΔH = +44 kJ
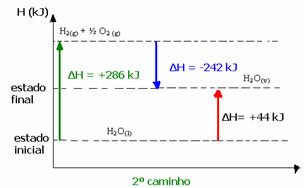
Имайте предвид, че независимо дали е извършена една или две стъпки, промяната на енталпията (ΔH) винаги е 44 kJ. Това е така, защото ΔH е алгебричната сума на ΔH стойностите на стъпките, които съставляват процеса, т.е. на междинните процеси:
| ΔH = ΔH1 + ΔH2 + ΔH3 + ... |
Например, във втория случай общата ΔH на реакцията е сумата от ΔH от първата стъпка (ΔH = +286 kJ) с тази от втората (ΔH = -242 kJ). По този начин получихме една и съща реакционна стойност с една стъпка:
ΔH = (+286 + (-242)) kJ
ΔH = (+286 -242) kJ
ΔH = +44 kJ
Следователно ние се интересуваме само от началните и крайните стойности. В този случай началното състояние съответства на H2О(1) и края на H2О(v).
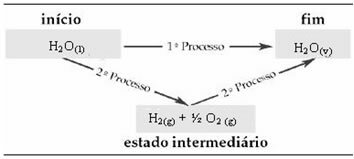
Този закон стана много важен в термохимията, тъй като някои химични реакции не могат да определят експериментално ΔH. Съгласно закона на Хес, енталпията на този тип реакция може да се изчисли от енталпиите на други реакции (междинни реакции).
От Дженифър Фогаса
Завършва химия
Училищен отбор на Бразилия
