
Понякога може да се случи минимална формула да бъде същата като молекулната формула на съединението; това обаче не винаги е вярно.
Например, емпиричната или минимална формула за вода е Н2О, което показва, че има съотношение 2: 1 между елементите, изграждащи водните молекули. И по случайност това е и молекулната формула за вода. За да видите обаче, че това не винаги се случва, вижте двата примера по-долу:
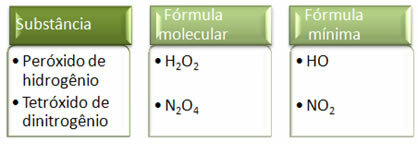
Тъй като минималната формула е само съотношението на атомите на всеки елемент, а не действителното количество от тях в молекулярната формула, може да се получи на различни съединения с една и съща емпирична формула и дори минималната формула на съединение може да бъде същата като молекулната формула на други. Забележете в примера по-долу как това може да се случи:
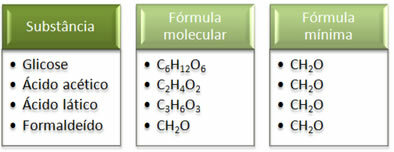
Вижте, че минималната формула CH2Това е еднакво за всички вещества, т.е. тази минимална формула изразява, че във всички случаи въглеродните, водородните и кислородните атоми присъстват в молекулните формули в съотношение 1:2:1. Освен това единственият, който има същата молекулна формула като емпиричната формула, е формалдехидът.
- Изчисляване на минималната или емпиричната формула:
За да се определи емпиричната формула на съединение, първо е необходимо да се знае какъв е неговият процент или приблизителна формула. Това може да стане чрез измерване на масата на всеки елемент в 100 g от пробата. Текстът "Процентна или центезимална формула”Изяснява този въпрос по-добре.
Например, да кажем, че близкият състав на дадено съединение е даден от: 40,00% C, 6,67% H и 53,33% O. Предаваме тези стойности на грамове, като се има предвид маса от 100 g проба от компост. По този начин имаме: 40 g С, 6,67 g Н и 53,33 g O.
Сега е необходимо тези стойности да се предадат на количеството вещество (mol). Правим това, като разделяме всяка от намерените стойности на съответните им моларни маси:
С: 40/12 = 3,33
Н: 6,67 / 1 = 6,67
O: 53,33 / 16 = 3,33
Тъй като стойностите не са цели числа, използваме следното устройство: разделяме всички стойности на най-малката от тях, така че пропорцията между тях да не се променя.
В този случай най-малката стойност е 3.33, така че резултатът ще бъде:
С: 3,33 / 3,33 = 1
Н: 6,67 / 3,33 = 2
O: 3.33 / 3.33 = 1
По този начин минималната формула на това неизвестно вещество е равна на: ° С1Н2О1 или CH2О.
Накратко, стъпките, необходими за намиране на емпиричната или минимална формула на веществото, са:

От Дженифър Фогаса
Завършва химия
Източник: Бразилско училище - https://brasilescola.uol.com.br/quimica/formula-minima-ou-empirica.htm

