Халогенидът е органично съединение, което има поне един халогенен атом. - тоест химични елементи от фамилия 17 или VII от Периодичната таблица (F, Cl, Br, I или общо: X) - прикрепен към група, получена от въглеводород.
RX (където X = F, Cl, Br или I)
Някои халогениди са показани по-долу:

Йодът е най-реактивен от всички, а флуорът най-малко, тъй като енергията на свързване между халогена и въглерода се увеличава от посоката на йода към флуора.
Друг момент е, че реактивността също се увеличава в този смисъл:

Следователно тази реактивност се проявява с по-голяма лекота при третичните въглеродни халогениди поради характера, придобит от въглерода, свързан с органичния халид:

По този начин заместителната група, като ОН, която ще образува алкохола, е по-силно привлечена от третичния въглерод, който има положителен характер (1+), и заместването е по-лесно.
Халогенидите могат да претърпят реакции, които ни позволяват да получим практически всички други органични функции (алкохол, етер, алкин, цианид или нитрил, амин и др.). Това обаче е невъзможно на практика, тъй като халогенидите са много скъпи съединения.
За да се получи алкохол, например, халидът реагира със силна основа, като натриев хидроксид, във водна среда. Да видим пример по-долу, в който от алкалната хидролиза на етилхлорид (хлороетан) ще се образува етанол:
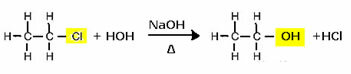
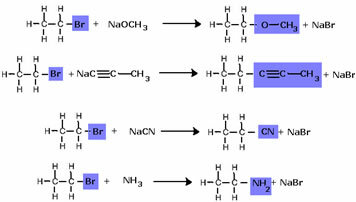
Обърнете внимание, че халогенидната група е заменена с ОН, алкохолната функционална група. Същата схема се следва за образуването на други групи, като се диференцира само реагентът:
От Дженифър Фогаса
Завършва химия
Училищен отбор на Бразилия
Източник: Бразилско училище - https://brasilescola.uol.com.br/quimica/reacoes-substituicao-haletos-organicos.htm
