Според модела на орбитали, създаден от Линус Полинг през 1960 г., ковалентната връзка, която образува молекули се получава чрез сливане или взаимопроникване на непълни орбитали на елементите, участващи в Връзка. Така се стига до заключението, че ако елементът има непълна орбитала (само с един електрон), той може да направи само ковалентна връзка. Ако има две непълни орбитали, може да направи максимум две връзки и т.н.
Погледнете обаче атомните орбитали на елемента въглероден атом, който има атомно число, равно на 6 (Z = 6):
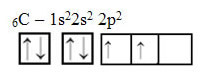
Имайте предвид, че има две непълни орбитали, така че трябва да изпълнява само две обвързвания. Това обаче не се случва с него. Както мнозина знаят, въглеродът прави четири връзки (той е четиривалентен), така че този модел на орбитали не обяснява случая с въглерода.
За да се сложи край на тази безизходица, беше създадена нова теория, която по-добре обясни този въпрос: Теория на хибридизацията.

Това означава, че хибридизацията е „смесица“ от чисти орбитали.
За въглерода има три вида хибридизация, които са: sp3, sp2 и sp.
За да разберем как се случва хибридизацията, нека разгледаме първия тип въглеродна хибридизация, тип sp.3:
Този тип хибридизация се среща в молекулата на метана (СН4). Имайте предвид, че има четири еднакви ковалентни връзки между въглерод, който е централният елемент, и четири водорода. И така, вижте какво е непълната водородна орбитала:
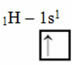
Тъй като всеки водород има непълна s-тип орбитала, е необходимо да се получи още един електрон, т.е. всеки един прави само една ковалентна връзка с въглерода. Ето защо въглеродът трябва да има четири непълни орбитали. Как става това? Чрез хибридизация.
Когато електрон от 2s орбиталата абсорбира енергия, той преминава в празната 2p орбитала. По този начин казваме, че този скок на електрона от 2s до 2p подниво е „промоция“ на електрона. По този начин въглеродът остава в своето възбудено или активирано състояние, с четири хибридизирани орбитали за осъществяване на ковалентните връзки:
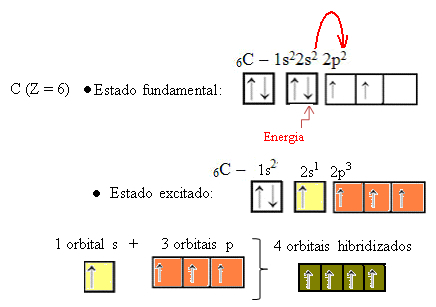
Имайте предвид, че образуваните хибридни орбитали са еквивалентни една на друга, но се различават от оригиналните чисти орбитали.
По този начин връзката между s-орбиталата на всеки от четирите водородни атома възниква с тези четири хибридизирани въглеродни орбитали:
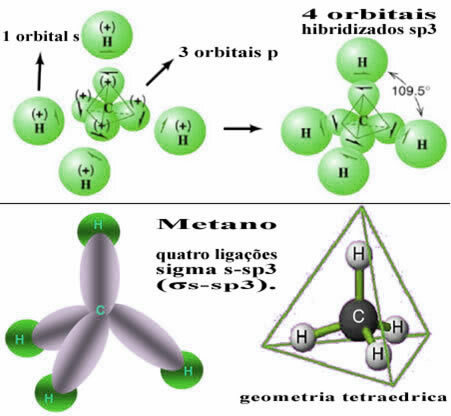
Както се вижда по-горе, молекулата на метана има правилна тетраедрова структура, с четирите електронни облака във всеки връх и съседни ъгли от 109 ° 28 ’. Тъй като връзката е направена между s орбитала на всеки водород и хибридизирана sp орбитала3 за всяка връзка, тогава имаме, че те са четири сигма s-sp връзки3 (σs-sp3).
От Дженифър Фогаса
Завършва химия
Източник: Бразилско училище - https://brasilescola.uol.com.br/quimica/hibridizacao-tipo-sp3.htm


