определя себе си като хибридизация обединението на непълни атомни орбитали. Орбиталата се класифицира като непълна, когато има само една електрон вътре в него вместо две. Вижте представяне на непълна орбитала и пълна орбитала:

На изображение А имаме пълна орбитала; на изображение Б, непълна орбитала.
Хибридизацията е естествено явление, което се случва с някои химични елементи, като фосфор, сяра, въглерод и др. Хибридизацията на въглерода позволява на атомите на този елемент да могат да образуват четири химически връзки, т.е. въглеродът създава четири връзки само след претърпяване на явлението хибридизация.
Но защо въглеродът хибридизира и създава четири връзки? За да разберем това явление, трябва да знаем електронното разпространение на този елемент:
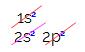
При електронното разпределение на въглерода виждаме, че 1s поднивото е завършено (с два електрона), 2s е пълен (с два електрона) и 2p поднивото е непълно (p поднивото поддържа шест електрона, но има само две). Разпределяйки 2р електроните по представителен начин, трябва:
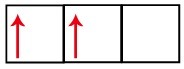
P-нивото има три орбитали - в случай на въглерод, две от тях са непълни, а едната е празна. Поради тази причина този елемент трябва да изпълнява само две връзки, тъй като броят на непълните орбитали винаги определя броя на връзките.
Въпреки това, когато получават енергия от външната среда, електроните, присъстващи във въглерода, се възбуждат. По този начин, един от електроните, присъстващи в подниво 2s, се придвижва до празната орбитала на подниво р
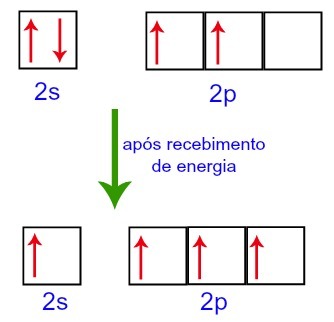
Въглеродни орбитали преди и след получаване на енергия от външната среда
По този начин въглеродът остава с четири непълни орбитали във второто си ниво. След това орбиталата на 2s подниво се присъединява към трите p орбитали, което конфигурира явлението хибридизация.
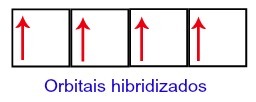
Въглеродни орбитали след хибридизация
От мен Диого Лопес Диас
Източник: Бразилско училище - https://brasilescola.uol.com.br/quimica/hibridizacao-carbono.htm