Алотропията е явление, което възниква, когато един и същ химичен елемент има свойството да образува повече от едно просто вещество.. Тези алотропни разновидности могат да се различават поради броя на атомите на елемента, които са свързани помежду си в молекула, или поради подреждането на атомите в кристалната решетка.
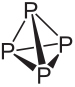
Един от елементите, които имат алотропни разновидности, е фосфорът (P), като най-често срещаният е бял фосфор това е червен фосфор. Тези два фосфорни алотропи се различават не по различното си пространствено разположение, тъй като и двете в основата си се състоят от тетраедрични молекули, а количеството фосфорни атоми е различно във всеки един.
Вижте конституцията и основните характеристики на белия и червения фосфор:
- Бял фосфор:
Молекулната формула на белия фосфор е P4, което означава, че молекулите му са изградени от четири фосфорни атома.

Този вид фосфор е изключително реактивен, до голяма степен поради опъването под ъглите 60 ° между връзките му. Той е толкова реактивен, че трябва да се съхранява във вода, за да не влиза в контакт с въздуха и да експлодира. При работа с него трябва да се внимава много, тъй като при поглъщане причинява тежки кожни изгаряния и отравяния (само погълнатият 0,1 g бял фосфор може да доведе до смърт).
Както можете да видите по-долу, белият фосфор е твърдо вещество, подобно на бял восък.

Бял фосфор, съхраняван във вода, за да не влиза в контакт с въздуха *
Ако се нагрява в отсъствието на въздух, белият фосфор се превръща в червен фосфор.
- червен фосфор:
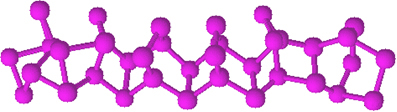
Червеният фосфор няма определена структура, но има доказателства, че това са макромолекули, образувани от свързването на споменатите тетраедрични структури (P4), представляван от Pне.
Той е много по-малко реактивен от белия фосфор, но може да се запали, ако се втрие. Ето защо се използва върху страничните повърхности на кибритените кутии. Когато търкаме клечката за зъби по повърхността на кутията, кибритът се запалва и от своя страна запалва лесно запалимия материал върху главата на клечката за зъби.
В някои страни кибритът се поставя върху главата на клечката за зъби под формата на P.4с3.
Червеният фосфор е аморфен прах, тоест той няма кристална структура и е тъмночервен на цвят, както е показано по-долу:

Червен фосфорен прах.
* Авторството на изображението принадлежи на W. Оелен и тя могат да бъдат намерени тук.
От Дженифър Фогаса
Завършва химия
Източник: Бразилско училище - https://brasilescola.uol.com.br/quimica/alotropia-fosforo.htm
