Френският химик Джоузеф Луи Пруст (1754-1826) продължи да извършва внимателни експерименти, отнасящи се до масите на компонентите на определени реакции.
Например елементите, които изграждат водата, са водород и кислород. Пруст установява, че при тази водообразуваща реакция водородът винаги е реагирал с кислород в постоянно и определено съотношение, което е съответно 1: 8. Вижте как се случва това по-долу:

Забележи това без значение колко маса от използваните елементи пропорцията винаги ще бъде еднаква.
Пруст отбеляза, че това не е само случаят с водата, а с всички останали вещества.
Образуват се 15,06 g меден сулфид (CuS), например при взаимодействие на 10,00 g метална мед (Cu) с 5,06 g сяра (S). И така, ако удвоим количеството мед (което ще достигне 20,0 g) и ако искаме цялата мед да реагира, също така ще е необходимо да се удвои количеството сяра, до 10,12 g, с общото образуване на 30,12 g от сулфид.
Сега, ако се добави сума, която не е пропорционална, излишната сума ще остане, тя няма да реагира. Забележете това по-долу:
Не спирайте сега... Има още след рекламата;)
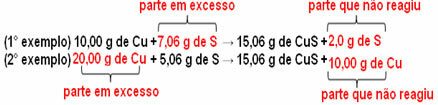
Забележи това реакцията протича само според определената пропорция. Следователно през 1799 г. Пруст заключава, че, когато няколко вещества се комбинират, за да образуват съединение, това винаги се прави в определена масова зависимост.
Така той създаде Закон, който се нарича Законът на Пруст, Закон за постоянните пропорции или Закон за определените пропорции, което се посочва, както следва:

Този закон и Законът на Лавоазие (Закон за масово опазване) са посочени Закони за теглото, тъй като те говорят в маси от участващи вещества.
От Дженифър Фогаса
Завършва химия
Искате ли да се позовавате на този текст в училище или академична работа? Виж:
FOGAÇA, Дженифър Роча Варгас. „Закон на Пруст или Закон за постоянните пропорции“; Бразилско училище. Наличен в: https://brasilescola.uol.com.br/quimica/lei-proust-ou-lei-das-proporcoes-constantes.htm. Достъп на 27 юни 2021 г.