НА Закон за скоростта на реакцията свързва скоростта на химична трансформация с концентрациите на реагентите в количество вещество (mol / L), което може да се заяви, както следва:

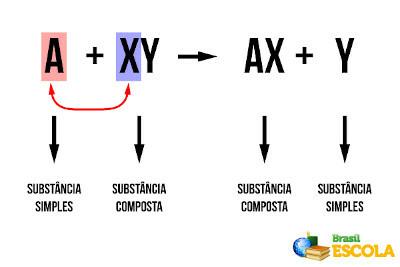
Например, помислете за следната обща реакция:
aA + bB → cC + dD
Да кажем, че увеличаваме концентрацията на реагентите А и В, какво ще се случи със скоростта на реакцията? Е, тъй като количеството на реактивните частици ще се увеличава в същото пространство, ще има по-ефективни сблъсъци между тях, което ще доведе до увеличаване на скоростта на развитие на реакцията. Което означава, че ще увеличи скоростта ви.
Следователно скоростта на реакцията е право пропорционална на концентрацията на реагентите. Това обаче зависи и от температурата. Следователно имаме следното математическо уравнение, което представлява закона за скоростта на реакцията:

На какво:
v = скорост на реакцията;
k = константа, която зависи само от стойността на температурата;
α и β = експоненти, определени експериментално.
Само когато реакцията е елементарна, тоест тя се осъществява в една стъпка, степенните показатели са точно равни на коефициентите на балансираното химично уравнение:
v = k. [THE]The. [B]Б.. В други случаи обаче подходящата сила, до която трябва да се повиши концентрацията на всеки реагент, трябва да бъде определена експериментално.Не спирайте сега... Има още след рекламата;)
Законът за скоростта на реакциите се нарича много имена, ето няколко: Закон за масовото действие, Уравнение на бързината, Кинетичен закон на реакцията и Закон на Гулдберг-Ваага.
Помислете за пример за прилагане на този закон:
Помислете за следната елементарна реакция:
2 НС1 (ж) → H2 (g) + Cl2 (g)
а) Напишете уравнението за скоростта на тази реакция;
б) Чрез експерименти в таблицата по-долу са отбелязани скоростта на тази реакция на разлагане на хлороводородния газ и концентрацията на този реагент при постоянна температура 25 ° C:
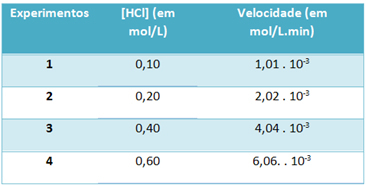
Въз основа на това определете характерната константа на скоростта на тази реакция при споменатата температура.
Резолюция:
The) v = k. [HCl]2
б) v = k. [HCl]2
k = __v___
[HCl]2
k = 1,01. 10-3 мол. L-1. мин-1
0,01 mol. L-1
k = 1,01. 10-1 мин-1
За да разрешите буквата „b“, можете да използвате данните на всеки от експериментите, че получената стойност ще бъде еднаква.
Но какво, ако реакцията не е елементарна? Как ще бъде възможно да се разрешат подобни въпроси при неелементарни реакции? За да разберете как, прочетете Закона за скоростта за неелементарни реакции.
От Дженифър Фогаса
Завършва химия
Искате ли да се позовавате на този текст в училище или академична работа? Виж:
FOGAÇA, Дженифър Роча Варгас. „Закон за скоростта на химичните реакции“; Бразилско училище. Наличен в: https://brasilescola.uol.com.br/quimica/lei-velocidade-das-reacoes-quimicas.htm. Достъп на 27 юни 2021 г.