Както е показано в текстовете "Електромагнитен спектър на химичните елементи" и "Спектри на емисии и абсорбция и законите на Кирххоф”, Прекъснатите емисионни спектри на всеки химичен елемент са различни.

И така, по-долу имаме различните спектри на някои от тези елементи:

По този начин датският физик Нилс Бьор (1885-1962) осъзнава, че това може да бъде свързано със структурата на атома на всеки от тези елементи. Затова той предложи атомен модел, който допълва модела на Ръдърфорд, но се фокусира върху поведението на околните електрони в ядрото на атома.
Малко по-рано Макс Планк (1858-1947) предлага теория, че електроните са квантован, в смисъл, че те излъчват и абсорбират специфични количества енергия, сякаш са малки енергийни пакети, който той се обади колко (квантов, в единствено число).
По този начин Бьор предложи следното: тъй като всеки елемент има различен спектър, всеки елемент има в атома си електрони с постоянна и различна енергия от елемент на елемент.
Всеки електрон може да остане само в определена специфична орбита, тъй като във всяка от тези орбити електронът има постоянна, добре дефинирана и характерна енергия. Електронът може да заема само енергийните нива, за които притежава съответната енергия.
Спектрите са прекъснати, тъй като електроните се квантуват.
Електронът може да променя нивата само ако абсорбира енергия. Например, когато изгаряте натриева сол в горелка на Бунзен, вие доставяте енергия на електроните. Когато поглъща квант енергия, електронът скача на друго по-енергийно ниво, като остава в възбудено състояние. Основното състояние обаче е по-стабилно, така че този електрон излъчва абсорбираната енергия и се връща в първоначалната си орбита. Той излъчва тази енергия под формата на електромагнитни вълни, които могат да бъдат визуализирани под формата на светлина. В случай на натрий, тази светлина е интензивно жълта на цвят. По този начин, когато тези вълни преминат през призма, се получава прекъснат спектър на натрий.
Така че, за Böhr, всяка светеща линия, която се появява в непрекъснатия спектър на елементите, показва енергията, освободена, когато електронът се върне от едно външно ниво към едно по-близо до ядрото.
Фигурата по-долу помага да се разбере по-добре този проблем:
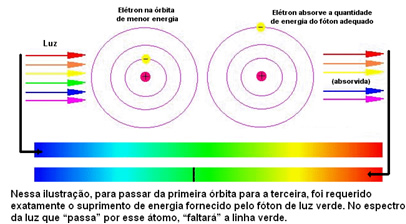
Тъй като на атомите на всеки елемент са разрешени само определени енергийни стойности, които съответстват на енергийните слоеве, за всеки елемент има различен спектър.
От Дженифър Фогаса
Завършва химия
Източник: Бразилско училище - https://brasilescola.uol.com.br/quimica/espectros-eletromagneticos-estrutura-atomo.htm
