О натриев хлорид (трапезна сол) е солта, която използваме в ежедневието си за осоляване на ръчно изработени или преработени (индустриализирани) храни. Това е вещество, което присъства и в различни естествени храни, консумирани ежедневно от нас, като плодове, зеленчуци, бобови растения, семена и т.н.
В този текст ще знаете всичко за това важно вещество за ежедневието на човека:
дефиницията
Натриевият хлорид принадлежи към неорганичната функция на солите и се състои от асоциацията на натриевия катион (Na+) това е анион cтаморето (Cl-) чрез a йонна връзка.
б) Химични характеристики
Натриевият хлорид се образува от два химични елемента:
→ Натрий (Na):
принадлежи към семейството на металите (способни лесно да образуват катиони) алкални (AI);
има електрон във валентната обвивка;
има атомен номер, равен на 11;
има висока електропозитивност (способност да губи електрони).
→ Хлор (Cl)
принадлежи към семейството халогени (VIIA);
той е неметален (затова става толкова лесно анион);
има седем електрона във валентната обвивка;
има атомен номер, равен на 17;
има висока електроотрицателност (способност за получаване на електрони).
Тъй като двата химични елемента, които образуват натриев хлорид, присъстват, съответно, висока електропозитивност и висока електроотрицателност, между тях има йонна връзка (установена между атоми с тенденция към загуба и печалба електрони).
Химичната структура на натриевия хлорид се състои от един хлориден анион (зелена сфера), който взаимодейства с шест натриеви катиона (сини сфери), както може да се види в структурата по-долу:
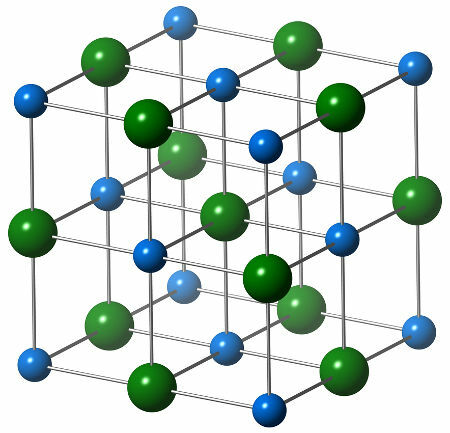
Представяне на кристалната структура на натриевия хлорид
в) Физически характеристики
Точка на синтез:
Натриевият хлорид може да се трансформира от твърдо състояние в течно състояние при температура 801 О° С.
Точка на кипене:
Натриевият хлорид може да се трансформира от течно в газообразно състояние при температура 1465 О° С.
Полярност
Тъй като това е вещество, произхождащо от йонна връзка, т.е., тъй като е йонно съединение, натриевият хлорид е полярен.
Разтворимост във вода
Можем да разтворим в 1 L вода, при 25 ОС, до 359 грама натриев хлорид.
Разтворимост в други разтворители:
Тъй като натриевият хлорид е полярно съединение, той не може да се разтвори в никакъв разтворител с неполярна природа, като масло.
Плътност:
Плътността на натриевия хлорид е 2,165 g / ml, поради което е по-плътна от водата, която има плътност, равна на 1 g / ml.
Електропроводимост:
Тъй като е йонно съединение, натриевият хлорид е способен да провежда електрически ток само когато:
-
Той е в разтопено състояние, т.е. течност;
Не спирайте сега... Има още след рекламата;)
Разтворена във вода.
г) Методи за получаване
Натриевият хлорид може да бъде получен физически или химически:
1О) Първи физически:
фракционна кристализация
Натриевият хлорид се получава чрез изпаряване на водата от океаните.
подземни мини
Извлича се в мини, използвайки минни техники.
подземни находища
Той се извлича от дълбоки подземни отлагания чрез разтваряне във вода (присъстващата в депозита сол се разтваря) и впоследствие се изпомпва.
2О) Получаване химически
реакция на синтез
Натриевият хлорид може да бъде получен чрез химична реакция на синтез (от прости вещества се получава съединение) между хлорния газ и металния натрий:
2 инча(с) + Cl2 (g) → 2 NaCl(с)
Реакция на неутрализация:
Друг начин за химично получаване на натриев хлорид е чрез реакцията на неутрализация между солна киселина и натриев хидроксид, при която имаме образуване на сол и вода:
HCI(1) + NaOH(тук) → NaCl(тук) + Н2О(1)
д) Значение за хората
Натриевият хлорид сам по себе си няма функция в човешкото тяло, но когато се дисоциира в натриеви катиони (Na+) и хлоридни аниони (Cl-), всеки от тези два йона има няколко важни функции за нашето тяло. Вижте някои от тези функции:
→ Функции на натриевия катион (Na+)
Предотвратява съсирването на кръвта;
Бори се с образуването на камъни в бъбреците и жлъчката;
Участва в регулирането на телесните течности;
Участва в регулирането на кръвното налягане.
→ Функции на хлоридния анион (Cl-)
Участие в образуването и съставянето на стомашния сок (солна киселина - HCl);
Участие в образуването на панкреатичен сок.
е) Увреждане на човешкото тяло
Прекомерната консумация на натриев хлорид може да причини следната вреда на хората:
→ Щети, причинени от излишък на натриеви катиони в организма:
Увеличено време за зарастване на рани;
Повишена честота на крампи;
Повишено кръвно налягане;
Претоварване на бъбреците;
Повишено задържане на течности в тялото.
→ Щети, причинени от излишък на хлоридни аниони в организма:
унищожаване на витамин Е;
Намаляване на производството на йод в организма.
ж) Други приложения
Освен че се използва за осоляване на храната, натриевият хлорид може да се използва и в следните ситуации:
Производство на шампоан;
Производство на хартия;
Производство на Натриев хидроксид (NaOH);
Производство на перилни препарати;
Производство на сапун;
Снегът се топи на места, които страдат от виелици;
Производство на метален натрий;
Производство на хлорен газ;
В изотоника за заместване на телесен електролит;
В разтвори за назален деконгестант;
Производство на физиологичен разтвор; наред с други приложения.
От мен Диого Лопес Диас
Искате ли да се позовавате на този текст в училище или академична работа? Виж:
ДНИ, Диого Лопес. „Натриев хлорид (готварска сол)“; Бразилско училище. Наличен в: https://brasilescola.uol.com.br/quimica/cloreto-sodio.htm. Достъп на 27 юни 2021 г.
Йонни съединения, основни характеристики на йонни съединения, свързване между йони, окончателен трансфер на електрони, електростатични сили на привличане между йони, отрицателни и положителни йони, аниони, катиони, йонна връзка, молекулярна структура той
Химия

Йонна връзка, споразумения между йонни съединения, йонни агломерати, натриев хлорид, готварска сол, йонно вещество, електростатични сили на привличане, хлоридни аниони, натриеви катиони, полярни разтворители, положителни йони, катиони, отрицателни йони, аниони.