Солна киселина е хидрацид с висок йонизационен потенциал, тя е жълтеникава течност, силно корозивна и токсична. Използва се в различни индустриални процеси, като производството на почистващи продукти и фармацевтични хидрохлориди, в храни и в процесите на производство на стомана.
Той присъства и в човешкия организъм; О стомашен сок който действа при храносмилането на протеини е киселинен разтвор; на солна и други вещества, като напр ензими и соли. Излагане, вдишване или поглъщане на Концентрираната солна киселина е силно вредна за здравето, което дори може да причини смърт.
Прочетете също: Сярна киселина - вещество, което има висока корозивна сила
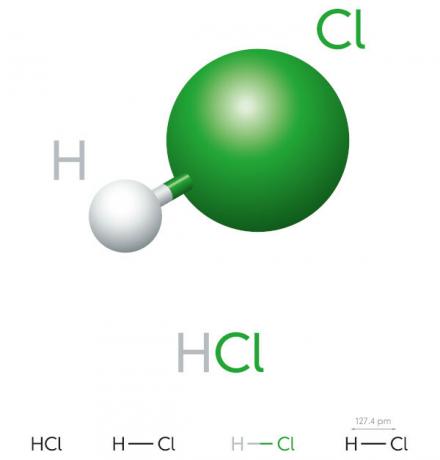
Свойства на солната киселина
- неорганично съединение
- силна киселина
- Висок йонизационен потенциал
- Течност
- жълтеникав вид
- Токсичен
- Корозивен
- Летлив
- Хигроскопичен (има тенденция да абсорбира áвода на околната среда)
- Разтворим във вода
Не спирайте сега... Има още след рекламата;)
Производство на солна киселина
Солната киселина беше открит от мюсюлмански алхимик наречен Jabir Ibne Haiane, известен също като Gaber и считан за баща на арабската химия. Той синтезира веществото въз основа на a реакция между морска сол (NaCl) и сярна киселина (В2САМО4).
2NaCl + Н2САМО4 → В2САМО4 + 2HCl
В момента солна киселина се произвежда в голям мащаб чрез електронниóлизис натриев хлорид във воден разтвор. От този процес се получава газ хлор (Cl2), газ водород (Н2) и натриев хидроксид (NaOH). Хлорът и водородните газове реагират, образувайки солна киселина:
Cl2 + Н2 → 2HCl
Въпреки това, тази реакция е изключително екзотермичен и силно опасно. В момента по-голямата част от солната киселина, произведена в промишлеността, е свързана с производството на органични съединения, като е по-икономичен и по-безопасен процес.
R-H + Cl2 → R-Cl + HCl
(Считайте R за органичен радикал.)
Вижте също: Съвети за определяне -ако силата на киселините

Приложение на солна киселина
- Мариноване на метал: Солната киселина се използва за „почистване“ на металите преди тяхната обработка, премахвайки ръждата, котления камък и други примеси от повърхността им.
- Производство на органични съединения: солната киселина се използва като реагент за получаване на винилхлорид, който се използва при производството на пластмаси. Солната киселина също идва от хлоропрен, който се използва в синтетични каучуци.
- Производство на неорганични съединения: солната киселина присъства в няколко промишлени процеса за производство на реагенти и съединения неорганични вещества, сред които са продукти за пречистване на вода, като железен (III) хлорид и алуминий.
- Използва се като почистващ продукт: Също така се предлага на пазара като муриатична киселина, солната киселина се използва за почистване на инструменти и машини след строителството, битови и химически почиствания.
- Обработка на храна: Солната киселина се използва в различни реакции за производството на храни и добавки, като хидролиза на нишесте и протеини, или в крайния продукт за баланс на рН.
- Производство на наркотици: Солната киселина се използва при производството на разтворими хидрохлориди, присъстващи в няколко лекарства, като доксициклин хидрохлорид, използвани при лечението на Коремен тиф и едра шарка.
Солна киселина в организма
Солната киселина присъства в нашата храносмилателната система, стомашният сок, произведен от стомаха ни, е разтвор на вода, ензими, солна киселина, неорганични соли и малък процент млечна киселина.
О хранителната торта се трансформира в химус, кисела маса (благодарение на действието на стомашния сок и неговия киселинен състав), това е, когато храносмилане на протеини, трансформирани в полипептиди и аминокиселини които ще бъдат усвоени от тялото.
Опасности от солна киселина
Солната киселина е много силна и разяждаща киселина, така че контактът с веществото причинява няколко щети:
- Кожа: Предизвиква изгаряния и дразнене.
- Очи: Предизвиква силно дразнене и може да причини слепота.
- Вдишване: Предизвиква дразнене и нараняване на горните дихателни пътища.
- поглъщане: причинява корозия в цялата устна система, а в стомашно-чревния тракт може да причини повръщане, кървене, диария, проблеми с кръвообращението, което може да доведе до смърт.
- Излаганеследва продължение: атакува първо области на лигавицата, причинявайки дерматит и конюнктивит, кървене на венците, фотосенсибилизация; честото вдишване, дори при ниска концентрация на съединението, може да причини гастрит и кървене от носа.
Също така достъп: Характеристики и свойства на оцетната киселина

решени упражнения
Въпрос 1 - (Udesc) По отношение на солната киселина може да се твърди, че:
А) когато е във воден разтвор, позволява преминаването на електрически ток.
Б) е киселина.
В) е слаба киселина.
Г) има ниска степен на йонизация.
Д) е йонно вещество.
Резолюция
Алтернатива А. Солната киселина не е двукиселина, тъй като има само един йонизируем Н, но един силна киселина, молекулярно вещество с висок йонизационен потенциал. НА йонизация във водна среда насърчава провеждането на електрически ток поради съществуването на свободни йони.
Въпрос 2 - В разтвор на солна киселина и вода можем да кажем, че появата на молекулен хлороводород (HCl) е минимална, тъй като
А) солната киселина в контакт с вода се разрежда.
Б) хлороводородът е вещество, което не се разтваря във вода.
В) хлороводородът има висок йонизационен потенциал, следователно, когато във водна среда молекулата НС1 образува Н йони+ Cl-.
Г) солната киселина, тъй като е много летлива, се отделя от разтвора, оставяйки само водни молекули.
Д) солната киселина е йонно вещество, поради което във воден разтвор тя се дисоциира, образувайки йони.
Резолюция
Алтернатива В.
А) Отговорът не е съгласен с въпроса, разреждането на солна киселина във вода не оправдава липсата на молекулна HCl.
Б) Неправилно, хлороводородът е разтворим и има афинитет към водата.
В) Правилно
Г) Въпреки че солната киселина е летлива, това разделяне на двата вида в разтвора не се проявява значително.
Д) Солната киселина е разтвор на хлороводород и вода, където хлороводородът е нейонно молекулярно вещество.
От Laysa Bernardes Marques de Araujo
Учител по химия
Искате ли да се позовавате на този текст в училище или академична работа? Виж:
ARAúJO, Laysa Bernardes Marques de. "Солна киселина"; Бразилско училище. Наличен в: https://brasilescola.uol.com.br/quimica/Acido-cloridrico.htm. Достъп на 27 юни 2021 г.