Електронно разпределение или електронна конфигурация по начина, по който са подредени химичните елементи, като се има предвид броят на електроните, които имат, и близостта им до атомното ядро.
Електронно диференцирано разпределение
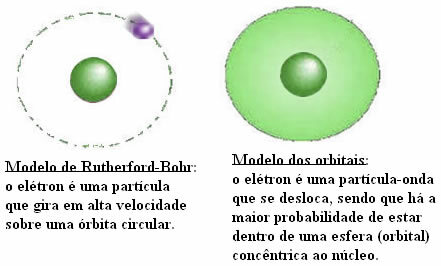
След появата на няколко атомни модела, моделът на Бор предлага организирането на електросферата в орбити.
Електроните са организирани и разпределени през електронните слоеве, като някои са по-близо до ядрото, а други по-далеч.

След това дойдоха 7-те електронни слоя (K, L, M, N, O, P и Q), които са представени от хоризонталните линии, номерирани от 1 до 7 в периодичната таблица.
Елементите на едни и същи линии имат еднакъв максимален брой електрони и също еднакви енергийни нива.
По този начин е възможно да се наблюдава, че електроните са в енергийни нива и поднива. Така че всеки има определено количество енергия.
|
Енергийно ниво |
Електронен слой |
Максимален брой електрони |
|---|---|---|
| 1° | К | 2 |
| 2° | L | 8 |
| 3° | М | 18 |
| 4° | н | 32 |
| 5° | О | 32 |
| 6° | P | 18 |
| 7° | Въпрос: | 8 |
НА валентен слой това е последният електронен слой, тоест най-външният слой на атома. Според Правило за октет, атомите имат тенденция да се стабилизират и да станат неутрални.
Това се случва, когато имат еднакво количество протони и неутрони, с осем електрона в последната електронна обвивка.
По-късно се появяват енергийните поднива, представени с малки букви s, p, d, f. Всяко подниво поддържа максимален брой електрони:
| поднива | Максимален брой електрони |
|---|---|
| с | 2 |
| P | 6 |
| д | 10 |
| е | 14 |
Диаграма на Полинг
Американският химик Линус Карл Полинг (1901-1994) изучава атомни структури и разработва схема, която се използва и до днес.
Полинг намери начин да постави всички енергийни поднива във възходящ ред, използвайки диагоналната посока. Схемата стана известна като Диаграма на Полинг.

Възходящ ред: 1s2 2 секунди2 2р6 3 секунди2 3p6 4s2 3d10 4р6 5s2 4г10 5p6 6s2 4f14 5 д10 6p6 7s2 5е14 6г10 7p6
Обърнете внимание, че числото, посочено пред енергийното подниво, съответства на енергийното ниво.
Например, в 1s2:
- с показва енергийното подниво
- 1 обозначава първото ниво, разположено на слой К
- степен 2 показва броя на електроните в това подниво
Как да направя електронно разпространение?
За да разберете по-добре процеса на електронно разпространение, разгледайте решеното упражнение по-долу.
1. Направете електронното разпределение на елемента Желязо (Fe), който има атомен номер 26 (Z = 26):
При прилагане на диаграмата на Линус Паулинг диагоналите се преминават в посоката, посочена в модела. Енергийните поднива се запълват с максималния брой електрони на електронна обвивка, докато завършат 26-те електрона на елемента.
За да направите разпределението, обърнете внимание на общия брой електрони във всяко подниво и в съответните електронни слоеве:
K - s2
L - 2s2 2р6
М - 3 секунди2 3p6 3d10
N - 4s2
Имайте предвид, че не беше необходимо да се извършва електронно разпределение във всички слоеве, тъй като атомният номер на желязото е 26.
По този начин електронното разпределение на този елемент е представено по следния начин: 1s2 2 секунди2 2р6 3 секунди2 3p6 4s2 3d6. Сумата от показателите е 26, т.е. общият брой на електроните, присъстващи в атома на желязото.
Ако електронното разпределение е обозначено със слоеве, то се представя по следния начин: K = 2; L = 8; М = 14; N = 2.
Възползвайте се от възможността да тествате знанията си в Упражнения по електронно разпространение.
В периодичната таблица, това е показано по следния начин:

Прочетете също:
- Електронен афинитет
- Квантови числа
- Упражнения върху периодичната таблица
- Упражнения за организиране на периодичната система