ти альдегіди та кетони вони дуже схожі на органічні функції. Обидва мають у своїй структурі карбонільну функціональну групу (C = O), з тією лише різницею, що у випадку альдегідів, він завжди з'являється в кінці вуглецевого ланцюга, тобто одним із карбонільних вуглецевих лігандів є водень; кетони містять карбоніл між двома іншими атомами вуглецю.
Функціональна група альдегідів:Функціональна група кетонів:
О О
║ ║
C C ─ H C C ─ C
З цієї причини існують випадки функціональної ізомерії між альдегідами та кетонами. Наприклад, нижче ми представляємо два функціональні ізомери, що мають однакову молекулярну формулу (C3H6O), але один - це альдегід (пропанал), а інший - кетон (пропанон). Подивіться, як це повністю змінює їх властивості та застосування:
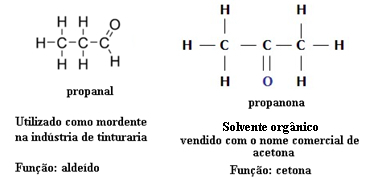
Приклад функціональної ізомерії між альдегідом та кетоном
Уявіть, що ви перебуваєте в лабораторії і знайдете флакон із безбарвною рідиною, що має лише молекулярну формулу С3H6О. Що б ви зробили, щоб дізнатись, це кетон чи альдегід?
Щоб вирішити подібні проблеми,
існують методи диференціювання альдегідів і кетонів, засновані на реакції цих сполук проти слабких окислювачів. Як показано нижче, зіткнувшись зі слабкими окислювачами, альдегіди реагують шляхом окислення, тоді як кетони не реагують. Ми так говоримоальдегіди діють як відновники, а кетони - ні, вони реагують лише як відновники в контакті з енергійними окислювачами.Альдегіди + слабкі окислювачі → карбонова кислота
О О
║ ║
C ─ C ─ H + [O] → C ─ C ─ OH
Кетони + слабкі окислювачі → Не реагувати
О
║
C ─ C ─ C + [O] → Жодної реакції не відбувається
Виходячи з цього, достатньо провести цю реакцію і перевірити, реагує сполука чи ні. Якщо воно реагує, ми знаємо, що це альдегід; якщо він не реагує, це кетон.
Крім того, продукти, що утворюються в цих реакціях окислення альдегіду, є цілком помітними, при цьому відбуваються зміни кольору, як це буде показано далі.
Існує три основних методи диференціювання альдегідів та кетонів, а саме:
1- Толленс Реактивний: Цей реагент являє собою аміачний розчин нітрату срібла, тобто він містить нітрат срібла (AgNO3) і надлишок гідроксиду амонію (NH4ОН):
AgNO3 + 3 NH4ОН → Ag (NH3) ОН + NH4БІЛЯ3 + 2 год2О
Толленс Реактив (названий на честь німецького хіміка Бернарда Толленса (1841-1918))
Як пояснюється в тексті Виготовлення срібного дзеркала, коли альдегід вводиться в контакт з реакційноздатною речовиною Толленса, він окислюється до відповідної карбонової кислоти, тоді як іони срібла відновлюються до Ag0 (металеве срібло). Якщо цю реакцію провести, наприклад, у пробірці, це металеве срібло осіде на стінках пробірки, що призведе до утворення плівки, яка називається срібне дзеркало. Цей спостережуваний результат дуже гарний і використовується в процесі виробництва промислових дзеркал.
Не зупиняйтесь зараз... Після реклами є ще щось;)
Реакція, яка має місце, може бути представлена наступним чином:
О О
║ ║
R ─ C ─ H + H2O → R ─ C ─ OH + 2e- + 2 H+
2 Ag+ + 2e- → 2 Ag0
2 NH3 + 2 год+ → 2 NH4+
О О
║║
R C ─ H + 2 Ag+ + 2 NH3 + Н2О → R C ─ ОН + 2 Ag0 + 2 NH4+
альдегід Толленс реактивнийкарбонова кислота металеве срібло (срібне дзеркало)
З іншого боку, якщо ми введемо кетон в реакцію з реактивом Толленса, утворення металевого срібла не відбудеться, оскільки кетони не можуть зменшити іони Ag.+.
2- Фелінговий реактив: Цей реактив є синім розчином мідного купоросу II (CuSO4) в основному середовищі, оскільки його змішують з іншим розчином, утвореним гідроксидом натрію (NaOH) та тартратом натрію та калію (NaOOC-CHOH-CHOH-COOK). Тартрат додають до розчину мідного купоросу ІІ для його стабілізації та запобігання його осадження.
CUSO4 + 2 NaOH → Na2ТІЛЬКИ4 + Cu (OH)2
Фелінг Реактив (названий на честь німецького хіміка Германа фон Фелінга (1812-1885))
У контакті з реакційноздатною речовиною Фелінга альдегід утворює карбонову кислоту шляхом її окислення, тоді як іони міді (Cu)2+), присутні в середині, відновлюються, утворюючи червонувато-коричневий осад (більше цегляний), який є оксидом купруму. Кетони, навпаки, не реагують - оскільки вони не можуть зменшити іони Cu2+.
О О
║ ║
R ─ C ─ H + 2 Cu (OH)2 → R ─ C ─ OH + Дупу2О + 2 год2О
альдегід червоно-коричневий осад
3- Реактив Бенедикта: Цей реактив також утворюється розчином сульфату міді II (Cu (OH)2) в основному середовищі, але його змішують з цитратом натрію.
Як і у випадку реагенту Фелінга, у випадку реакції між альдегідом та реагентом Бенедикта є також іони міді (Cu2+) присутні в середовищі, які відновлені і утворюють червоний оксид купруму.
Цей реактив широко використовується в тестах для виявлення присутності та вмісту глюкози в сечі. У своїй структурі глюкоза має альдегідну групу, тому вона реагує з реагентом Бенедикта, який присутній у смужках для цих тестів. Потім порівняйте колір стрічки з кольором луски на упаковці товару.

Реагент Бенедикта використовується для визначення вмісту глюкози в сечі.
Дженніфер Фогача
Закінчив хімію
Хотіли б ви посилатися на цей текст у школі чи академічній роботі? Подивіться:
FOGAÇA, Дженніфер Роша Варгас. «Диференціація альдегідів та кетонів»; Бразильська школа. Доступно: https://brasilescola.uol.com.br/quimica/diferenciacao-aldeidos-cetonas.htm. Доступ 27 червня 2021 року.
Хімія

Альдегіди, карбонільні сполуки, карбонільна група, основні альдегіди, Етанал, сировина для пестицидів та наркотиків, Метанал, формальдегід, пластмаса та смола.
Хімія

Кетони, органічні речовини, карбонільна функціональна група, отримання розчинника емалі, пропанон, кетонові тіла в крові, вилучення олій і жирів з насіння рослин, розчинників Органічний.

