Один змішування розчинів тієї ж розчиненої речовини без хімічної реакції воно полягає у поєднанні в одному контейнері двох розчинів, наприклад, хлористого калію (Kcl). У цьому типі суміші ніколи не відбудеться хімічної реакції через наявність рівних розчинених речовин, тобто обидва мають однаковий катіон та однаковий аніон. Таким чином, ми можемо сказати, що, коли ми проводимо суміш з цими характеристиками, ми просто додаємо кількість розчиненої речовини та розчинника, що складають обидва розчини.
Якщо ми змішаємо, наприклад, розчин 1 л води і 4 грами KI (йодистого калію) з іншим розчином 2L води і 6 грамів KI, ми отримаємо новий розчин 3L води і 10 грамів KI .
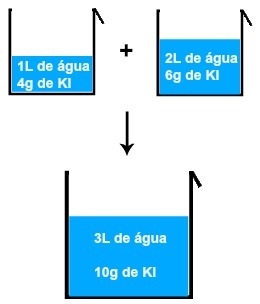
Результат змішування двох розчинів йодистого калію
Аналізуючи зображення, можна зробити висновок маса розчиненої речовини (м1') першого розчину додається до маси розчиненої речовини (м1'') другого рішення, в результаті чого маса розчиненої речовини (мF) в остаточному рішенні (Мікс):
м1'+ м1'' = мF
У прикладі:
4 + 6 = 10 грам
Те саме відбувається з об'ємом води, присутньої в кожному розчині, тобто об'єм першого (V '), доданий до обсягу другого (V' '), призводить до кінцевого об'єму (V'
F):V '+ V' '= VF
У прикладі:
1 + 2 = 3 л
Оскільки кожен розчин має кількість розчиненої розчиненої речовини, і тут ми маємо суміш розчинів тієї ж розчиненої речовини, тоді ми можемо, з вищесказаного, визначити концентрацію (загальну, молярність) кожного із змішаних розчинів, а також кінцевого розчину.
Тому ми повинні пам’ятати формули для розрахунку таких концентрацій:
Загальна концентрація:
C = м1
V
м1 = маса розчиненої речовини розчину
V = об'єм розчину
ПРИМІТКА: ізолюючи m1 у формулі маємо: м1 = CV
Молярність:
М = м1
М1.V
М1 = молярна маса розчиненої речовини.
ПРИМІТКА: ізолюючи m1 у формулі маємо: м1 = М.М.1.V
Оскільки суміш розчинів тієї самої розчиненої речовини звертається до суми маси розчиненої речовини розчинів, ми можемо підставити кожне із спостережень у такий вираз:
м1'+ м1'' = мФ
C'.V '+ C' '. V' '= CF.VF
Не зупиняйтесь зараз... Після реклами є ще щось;)
C '= загальна концентрація розчину 1
C '' = загальна концентрація розчину 2
Якщо розрахунок суміші розчинів передбачає молярність:
м1'+ м1'' = мF
M'.V '+ M' '. V' '= MF.VF
ПРИМІТКА: Оскільки розчинена речовина однакова, молярна маса однакова в кожному з розчинів; тому нею нехтують при розрахунку.
тепер дивись приклади, що охоплюють розрахунки в суміші розчинів тієї самої розчиненої речовини без хімічної реакції:
Приклад 1: (Mackenzie-SP-Adaptada) Додаючи 600 мл розчину КОН 14 г / л до певного об’єму (v) 84 г / л розчину тієї ж основи, отримують 67,2 г / л розчину. Доданий об’єм (v) розчину 84 г / л становить:
а) 0100 мл
б) 3000 мл
в) 2700 мл
г) 1500 мл
д) 1900 мл
Дані, надані вправою:
V '= 600 мл
C '= 14 г / л
V '' =?
C '' = 84 г / л
VF = ?
CF = 67,2 г / л
Перш ніж визначати доданий об’єм розчину 1, ми спочатку повинні визначити кінцевий об’єм за допомогою такого виразу:
V '+ V' '= VF
600 + V '' = VF
Підставивши значення, наведені в математичному виразі нижче, маємо:
C'.V '+ C' '. V' '= CF.VF
14. 600 + 84.V '' = 67.2. (600 + V '')
8400 + 84.V '' = 67,2. 600 + 67,2.V ''
8400 + 84.V '' = 40320 + 67.2.V ''
84.V '' - 67.2.V '' = 40320 - 8400
16.8.V '= 31920
V '' = 31920
16,8
V '' = 1900 мл
Приклад 2: (UFOP) У мірну колбу об'ємом 1000 мл 250 мл 2М розчину сірчаної кислоти додавали 300 мл 1M розчину тієї ж кислоти і об'єм доводили дистильованою водою до 1000 мл. Визначте молярність отриманого розчину.
Дані, надані вправою:
V '= 250 мл
М '= 2 М
V '' = 300 мл
М '' = 1 М
VF = 1000мл
МF = ?
Щоб визначити молярність остаточного рішення, просто використовуйте математичний вираз, який представляє процес:
M'.V '+ M' '. V' '= MF.VF
2. 250 + 1. 300 = МF.1000
500 + 300 = МF. 1000
800 = МF
1000
МF = 0,8 моль / л
Мені Діого Лопес Діас
Хотіли б ви посилатися на цей текст у школі чи академічній роботі? Подивіться:
ДНІ, Діоґо Лопес. «Суміш розчинів тієї ж розчиненої речовини без хімічної реакції»; Бразильська школа. Доступно: https://brasilescola.uol.com.br/quimica/mistura-solucoes-mesmo-soluto-sem-reacao-quimica.htm. Доступ 27 червня 2021 року.