อิเล็กโทรลิซิสเป็นกระบวนการที่อุตสาหกรรมเคมีใช้กันอย่างแพร่หลาย เนื่องจากช่วยให้ได้รับ สารที่ไม่มีอยู่ในธรรมชาติ เช่น คลอรีน ไอโอดีน โซดาไฟ เป็นต้น คนอื่น ๆ
อิเล็กโทรไลซิสเป็นสิ่งที่ตรงกันข้ามของเซลล์ซึ่งไฟฟ้าได้มาจากปฏิกิริยารีดอกซ์นั่นคือพลังงานเคมีจะเปลี่ยนเป็นพลังงานไฟฟ้า แล้ว ในอิเล็กโทรไลซิส ไฟฟ้าใช้ในการผลิตปฏิกิริยารีดอกซ์และพลังงานเคมี
จึงมีที่มาของชื่อคือ ไฟฟ้า หมายถึง "กระแสไฟฟ้า" และ สลายตัว หมายถึง "แตก" นั่นคือสิ่งที่เกิดขึ้น กระแสไฟฟ้าจะแตกหรือสลายสารที่อยู่ภายใต้มัน
แบตเตอรี่เป็นกระบวนการที่เกิดขึ้นเอง แต่อิเล็กโทรไลซิส มันเป็นกระบวนการที่ไม่เกิดขึ้นเองซึ่งต้องสตาร์ทด้วยกระแสไฟฟ้า
อิเล็กโทรไลซิสมีสองประเภท: a คะนอง และ ในน้ำปานกลาง. ในบทความนี้เราจะจัดการกับกรณีแรก
ความแตกต่างระหว่างอิเล็กโตรไลซิสอัคนีและอิเล็กโทรไลซิสในตัวกลางที่เป็นน้ำคือรูปแบบที่สารที่จะตกอยู่ภายใต้กระแสไฟฟ้าคือ ในกรณีของอิเล็กโทรไลซิสแบบอัคนี สารไอออนิกจะอยู่ในสถานะของเหลว กล่าวคือ หลอมเหลวโดยไม่มีน้ำ คำว่า "คะนอง" มาจากภาษาละติน คะนองซึ่งหมายถึง "การเผาไหม้, อักเสบ".
ในอิเล็กโทรไลซิสจะใช้ภาชนะที่เรียกว่า a
คิวบา หรือ เซลล์อิเล็กโทรไลต์ที่ซึ่งอิเล็กโทรดสองขั้วถูกติดตั้งไว้ซึ่งกระแสไฟฟ้าจะไหลผ่าน อิเล็กโทรดสามารถ เฉื่อย (ห้ามเปลี่ยนระหว่างอิเล็กโทรไลซิส) หรือ คล่องแคล่ว (พวกเขาประสบกับการเปลี่ยนแปลงบางอย่างระหว่างอิเล็กโทรไลซิส) ที่ใช้กันมากที่สุดคือสารเฉื่อยที่ทำจากแพลตตินั่มหรือกราไฟท์อิเล็กโทรดจะเชื่อมต่อกับแหล่งจ่ายกระแสตรง (เซลล์หรือแบตเตอรี่) ขั้วลบของแบตเตอรี่จะจ่ายอิเล็กตรอนให้กับอิเล็กโทรดตัวใดตัวหนึ่ง กลายเป็นประจุลบ และจะดึงดูดไอออนบวก (ไอออนบวก) จากสารที่หลอมเหลว เนื่องจากมันดึงดูดไอออนบวก อิเล็กโทรดลบนี้จึงเรียกว่าแคโทด ในนั้นไอออนบวกรับอิเล็กตรอนและลดลง
อิเล็กโทรดบวกดึงดูดแอนไอออน (ไอออนลบ) และด้วยเหตุนี้จึงเรียกว่าแอโนด แอนไอออนจะปล่อยอิเลคตรอนที่แอโนดและเกิดปฏิกิริยาออกซิเดชัน
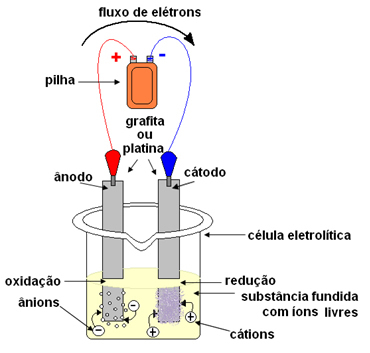
ในแบตเตอรี่ อิเล็กโทรดบวกเรียกว่าแคโทด และขั้วลบคือแอโนด ในอิเล็กโทรไลซิสมันตรงกันข้าม แอโนดเป็นขั้วบวก และแคโทดเป็นขั้วลบ อย่างไรก็ตาม ในทั้งสองกรณี ในแบตเตอรี่และในอิเล็กโทรไลซิส ที่ขั้วบวกมีการเกิดออกซิเดชัน และที่ขั้วลบมีการลดลง
สั้น ๆ เรามี:

ข้อเท็จจริงที่สำคัญอีกประการหนึ่งคือ เซลล์หรือแบตเตอรี่ที่ใช้สร้างกระแสไฟฟ้าต้องมี ddp (ความต่างศักย์) เท่ากับหรือมากกว่าความต่างศักย์ของปฏิกิริยา
เพื่อให้เข้าใจได้ดียิ่งขึ้นว่ากระบวนการอิเล็กโทรไลซิสเกิดขึ้นได้อย่างไรและสลายสารที่สร้างองค์ประกอบสำคัญหรือสารอย่างง่ายได้อย่างไร โปรดอ่านข้อความ อิเล็กโทรไลซิสโซเดียมคลอไรด์อัคนี.
โดย เจนนิเฟอร์ โฟกาซา
จบเคมี
ที่มา: โรงเรียนบราซิล - https://brasilescola.uol.com.br/quimica/eletrolise-Ignea.htm

