ถูกเรียก ลำแสงไอออน ขนาดของไอออน การศึกษาคุณสมบัตินี้ขึ้นอยู่กับความรู้เกี่ยวกับรัศมีอะตอมและไอออน
รัศมีอะตอม: คือการวัดขนาดของอะตอมที่เป็นกลาง (ระยะทางตามทฤษฎีจากนิวเคลียสไปยังอิเล็กโตรสเฟียร์สุดท้าย)
ไอออน: อะตอมที่สูญเสีย (ไพเพอร์) หรือได้รับอิเล็กตรอน (แอนไอออน)
โปรตอนภายในนิวเคลียสของ a อะตอม ออกแรงดึงดูดให้อิเล็กตรอน (อนุภาคลบ) ที่มีอยู่ในอิเล็กโตรสเฟียร์ ยิ่งจำนวนโปรตอนมากเท่าไร แรงดึงดูดก็ยิ่งมากขึ้นเท่านั้น และในทางกลับกัน เมื่อจำนวนอิเล็กตรอนในอะตอมถูกแก้ไขโดยการสูญเสียหรือการเพิ่มของอนุภาคเหล่านี้ แรงดึงดูดระหว่างโปรตอนและอิเล็กตรอนจะถูกปรับเปลี่ยนดังนี้:
ในกรณีของไอออนบวก:
จำนวนอิเล็กตรอนในอิเล็กโตรสเฟียร์จะน้อยกว่าจำนวนโปรตอนภายในนิวเคลียส ซึ่งทำให้แรงดึงดูดของนิวเคลียสมากขึ้น ดึงอิเล็กตรอนเข้าไปใกล้มันมากขึ้น อิเล็กโทรสเฟียร์ ผลที่ได้คือรัศมีของอะตอมลดลง ดังนั้นรัศมีของไอออนบวกจะเล็กกว่ารัศมีของอะตอมที่เป็นกลางเสมอ
รัศมีอะตอมเป็นกลาง > รัศมีไอออนบวก
ในกรณีของประจุลบ:
จำนวนอิเล็กตรอนในอิเล็กโตรสเฟียร์จะมากกว่าจำนวนโปรตอนภายในนิวเคลียส ในกรณีนี้ แรงดึงดูดที่กระทำโดยนิวเคลียสจะถูกเอาชนะด้วยแรงผลักระหว่างอิเล็กตรอนที่อยู่ในอิเล็กโตรสเฟียร์ ผลที่ได้คือรัศมีของอะตอมเพิ่มขึ้น ดังนั้นรัศมีของประจุลบจะมากกว่ารัศมีของอะตอมที่เป็นกลางเสมอ
อย่าเพิ่งหยุด... มีมากขึ้นหลังจากโฆษณา ;)
รัศมีประจุลบ > รัศมีอะตอมเป็นกลาง
สองสถานการณ์ด้านล่างนี้เป็นตัวอย่างที่ดีของสิ่งที่เกิดขึ้นกับรัศมีของไอออน:
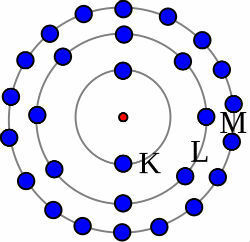
1) อะตอมโซเดียมเป็นกลาง (11Na) และโซเดียมไอออนบวก (11ที่+)
ในขณะที่โซเดียมอะตอมเป็นกลางมีโปรตอน 11 ตัว (ทรงกลมสีเหลือง) และอิเล็กตรอน 11 ตัว (ทรงกลมสีแดง) โซเดียมไอออนบวกมีโปรตอน 11 ตัวและอิเล็กตรอน 10 ตัว

แบบจำลองอะตอมเป็นกลางของโซเดียม
เมื่ออะตอมโซเดียมเป็นกลางสูญเสียอิเล็กตรอน รัศมีจะลดลง
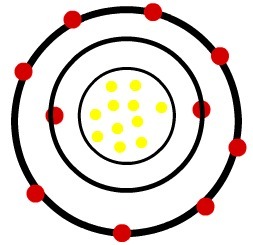
แบบจำลองของโซเดียมไอออนบวก
การสังเกต: ระดับที่สามไม่ได้แสดงในรูปของไอออนบวก เพราะเนื่องจากมันสูญเสียอิเล็กตรอนเพียงตัวเดียวที่มันมีอยู่ มันจึงว่างเปล่า ดังนั้นจึงถูกละเลย แต่ก็มีอยู่
2) อะตอมที่เป็นกลางของฟอสฟอรัส (15P) และฟอสฟอรัสไอออนบวก (15พี-3)
ในขณะที่อะตอมของฟอสฟอรัสที่เป็นกลางมีโปรตอน 15 ตัว (ทรงกลมสีเหลือง) และอิเล็กตรอน 15 ตัว (ทรงกลมสีแดง) ไอออนของฟอสฟอรัสมีโปรตอน 15 ตัวและอิเล็กตรอน 18 ตัว
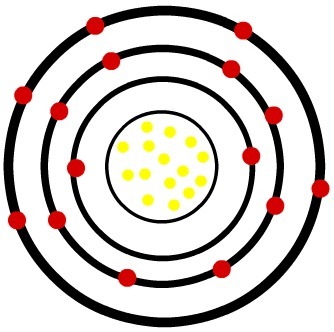
แบบจำลองของอะตอมของสารเรืองแสงที่เป็นกลาง
เมื่ออะตอมของฟอสฟอรัสเป็นกลางได้รับอิเล็กตรอน 3 ตัว รัศมีจะเพิ่มขึ้น
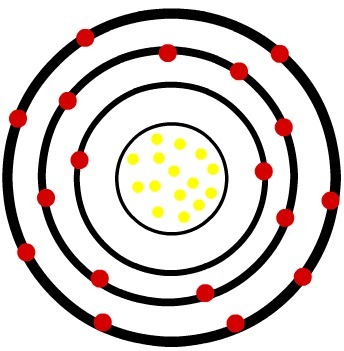
แบบจำลองของแอนไอออนของฟอสเฟอร์
By Me. ดิโอโก้ โลเปส ดิอาส
คุณต้องการอ้างอิงข้อความนี้ในโรงเรียนหรืองานวิชาการหรือไม่ ดู:
DAYS ดิโอโก้ โลเปส "รัศมีไอออนิก"; โรงเรียนบราซิล. มีจำหน่ายใน: https://brasilescola.uol.com.br/quimica/raio-ionico.htm. เข้าถึงเมื่อ 28 มิถุนายน 2021.