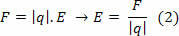ในปี ค.ศ. 1911 เออร์เนสต์ รัทเทอร์ฟอร์ด นักฟิสิกส์ชาวนิวซีแลนด์ พร้อมด้วยผู้ร่วมมือ ได้ทำการทดลองซึ่งเขาได้ทิ้งระเบิดใบมีดทองคำบางๆ ด้วย อนุภาคแอลฟาจากพอโลเนียม (ธาตุเคมีกัมมันตภาพรังสี) การวิเคราะห์การทดลองนี้ทำให้รัทเทอร์ฟอร์ดได้ข้อสรุปว่า ถึงจุดสุดยอดในการประกาศแบบจำลองอะตอมใหม่ ซึ่งเขาสันนิษฐานว่าอะตอมประกอบด้วยนิวเคลียสที่เป็นบวกหนาแน่นและมีอิเล็กตรอนโคจรรอบ การกลับมาของคุณ
อย่างไรก็ตาม ฟิสิกส์คลาสสิกได้วิพากษ์วิจารณ์แบบจำลองของรัทเทอร์ฟอร์ดอย่างรุนแรง เนื่องจากตามทฤษฎีแม่เหล็กไฟฟ้าแบบคลาสสิกของแมกซ์เวลล์ ประจุที่เคลื่อนที่ด้วยความเร่งจะปล่อยประจุออกมา คลื่นแม่เหล็กไฟฟ้า ดังนั้น อิเล็กตรอนที่หมุนรอบนิวเคลียสควรปล่อยรังสี สูญเสียพลังงาน และตกลงไปในนิวเคลียสในที่สุด และเรารู้อยู่แล้วว่ามันไม่ได้ มันเกิดขึ้น.
ในปี ค.ศ. 1914 นักฟิสิกส์ชาวเดนมาร์ก นีลส์ โบร์ ได้เสนอแบบจำลองที่เรียกว่าอะตอมของบอร์ หรือแบบจำลองอะตอมของบอร์ บนพื้นฐานของสมมติฐานที่จะแก้ปัญหาของแบบจำลองรัทเทอร์ฟอร์ด อธิบายว่าทำไมอิเล็กตรอนจะไม่ตกลงไปในก้นหอย แกน ตามที่ฟิสิกส์คลาสสิกทำนายไว้ Bohr สันนิษฐานว่าอิเล็กตรอนหมุนรอบนิวเคลียสในวงโคจร เป็นไปได้ กำหนด และเป็นวงกลมเนื่องจากแรงไฟฟ้า ซึ่งสามารถคำนวณได้โดยกฎของคูลอมบ์ผ่าน ของสมการ:
ฉ = ke²
r²
เขาเรียกพวกมันว่าวงโคจรที่อยู่กับที่ นอกจากนั้น อิเล็กตรอนไม่ได้ปล่อยพลังงานออกมาเองตามธรรมชาติ ในการกระโดดจากวงโคจรหนึ่งไปยังอีกวงโคจรหนึ่งจะต้องได้รับโฟตอนพลังงานที่สามารถคำนวณได้ ดังนั้น:
อี = อีฉ - ANDผม = hf
ด้วยวิธีนี้ อิเล็กตรอนจะยังคงอยู่ในวงโคจรอย่างไม่มีกำหนด เว้นเสียแต่ว่าจะได้รับปริมาณพลังงานที่จำเป็นในการกระโดดจากวงโคจรหนึ่งไปยังอีกวงโคจรหนึ่งซึ่งอยู่ห่างจากนิวเคลียสมากขึ้น
Bohr คำนวณพลังงานที่สอดคล้องกับแต่ละวงโคจร ดูว่าเราจะบรรลุผลลัพธ์เดียวกันได้อย่างไร:
แรงไฟฟ้าทำหน้าที่เป็นแรงสู่ศูนย์กลาง ดังนั้นเราจึงมี:
mv² = ke², แล้ว mv² = ke² (ผม)
r r² r
พลังงานจลน์ของอิเล็กตรอนถูกกำหนดโดยEค = ½ mv². เราจะหาได้จากที่ไหน:
และค = ke²
ครั้งที่ 2
พลังงานศักย์ของอิเล็กตรอนได้มาจาก: Eพี = - ke² (II)
r
อย่าเพิ่งหยุด... มีมากขึ้นหลังจากโฆษณา ;)
พลังงานทั้งหมดจะเป็น: E = Eค + และพี
อี = ke² – ke² = - ke² (สาม)
2r r 2r
Niels Bohr สันนิษฐานเพิ่มเติมว่าผลิตภัณฑ์ mvr ควรเป็นจำนวนเต็มทวีคูณ (n) ของ h/2π นั่นคือ:
mvr = ฮะ
2π
กับ n = 1,2,3...
ดังนั้นเราจึงสามารถทำได้:
วี = ฮะ (IV)
2πmr
แทนค่านี้ในสมการ (I) เรามี:
ม.( ฮะ )² = ke²
2πmr
m²h² = ke²
4π²m²r² r
ซึ่งส่งผลให้: n²h² = ke²
4π²mr² r
n²h² = ke²
4π²mr
4π²mr = 1
n²h² ke²
ดังนั้น r = n²h²
4π²mke²
ร = ตร.ม . n² (V)
4π²mke²
แทนที่ V ใน III
และไม่ = - 2π² m k²e4 . 1 (ซอว์)
h² n²
ด้วยสมการ (VI) ข้างต้น เป็นไปได้ที่จะคำนวณพลังงานของอิเล็กตรอนในวงโคจรที่อนุญาต โดยที่ n = 1 สอดคล้องกับสถานะต่ำสุด พลังงานหรือสถานะพื้นซึ่งจะออกไปก็ต่อเมื่อตื่นเต้นผ่านโฟตอนที่ได้รับกระโดดขึ้นไปอีก พลังงานซึ่งจะคงอยู่เป็นระยะเวลาสั้น ๆ ในไม่ช้าก็จะกลับสู่สภาพพื้นดินโดยปล่อยโฟตอนของ พลังงาน. แบบจำลองอะตอมของบอร์อธิบายอะตอมโมโนอิเล็กทรอนิกส์ของไฮโดรเจนดี และสำหรับอะตอมเพิ่มเติม คอมเพล็กซ์ ยังต้องการทฤษฎีใหม่ ทฤษฎีชโรดิงเงอร์ ซึ่งอยู่ในขอบเขตของกลศาสตร์อยู่แล้ว ควอนตัม
โดย เปาโล ซิลวา
จบฟิสิกส์
คุณต้องการอ้างอิงข้อความนี้ในโรงเรียนหรืองานวิชาการหรือไม่ ดู:
ซิลวา, เปาโล โซอาเรส. "อะตอมของบอร์"; โรงเรียนบราซิล. มีจำหน่ายใน: https://brasilescola.uol.com.br/fisica/atomo-bohr.htm. เข้าถึงเมื่อ 28 มิถุนายน 2021.