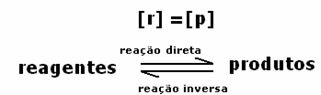
สมดุลไดนามิกหรือสมดุลทางเคมีของปฏิกิริยาเกิดขึ้นเมื่อปฏิกิริยาไปข้างหน้าและย้อนกลับเกิดขึ้นพร้อมกัน ระบบย้อนกลับที่เรียกว่าเหล่านี้แสดงด้วยลูกศรในทั้งสองทิศทาง:  หรือ
หรือ  . ตัวอย่างของปฏิกิริยาที่ย้อนกลับได้ในรูปภาพด้านบน ระหว่างก๊าซไอโอดีนและก๊าซไฮโดรเจน
. ตัวอย่างของปฏิกิริยาที่ย้อนกลับได้ในรูปภาพด้านบน ระหว่างก๊าซไอโอดีนและก๊าซไฮโดรเจน
ที่จุดเริ่มต้นของปฏิกิริยา ปริมาณของสารตั้งต้นจะสูงสุดและผลิตภัณฑ์จะเป็นศูนย์ อย่างไรก็ตาม สารตั้งต้นทำปฏิกิริยาซึ่งกันและกัน ทำให้ความเข้มข้นของสารตั้งต้นลดลงและเพิ่มความเข้มข้นของผลิตภัณฑ์ที่เกิดขึ้น อัตราการพัฒนาของปฏิกิริยาโดยตรงก็ลดลงเช่นกัน
เมื่อความเข้มข้นของผลิตภัณฑ์เพิ่มขึ้น ปฏิกิริยาผกผันจะเริ่มขึ้นและสารตั้งต้นจะก่อตัวขึ้นอีกครั้ง อัตราการพัฒนาของปฏิกิริยาผกผันก็เพิ่มขึ้นเช่นกัน
เมื่อถึงจุดสมดุลทางเคมี ที่อุณหภูมิคงที่ อัตราการพัฒนาของปฏิกิริยาไปข้างหน้าและย้อนกลับจะเท่ากัน
ทั้งหมดโดยตรง = ทั้งหมด ผกผัน
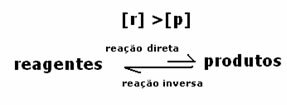
อัตราเท่ากัน แต่ความเข้มข้นไม่เท่ากัน ความเข้มข้นของน้ำยาและผลิตภัณฑ์ไม่น่าจะเท่ากัน สิ่งนี้จะเกิดขึ้นได้ในบางกรณีเท่านั้น ในกรณีส่วนใหญ่ความเข้มข้นของรีเอเจนต์จะสูงกว่าผลิตภัณฑ์หรือในทางกลับกัน
ดังนั้นเราจึงมีสามวิธีที่เป็นไปได้ในการแสดงอัตราการพัฒนาของ .แบบกราฟิก ปฏิกิริยาโดยตรงและผกผัน เกี่ยวข้องกับความเข้มข้นของสารตั้งต้นและผลิตภัณฑ์เหนือ เวลา. ลองดูแต่ละกรณี:
กรณีที่ 1: ความเข้มข้นเท่ากัน:
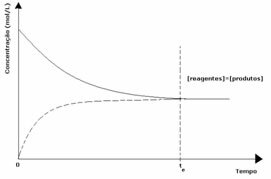
ดังที่เห็นในกราฟ ณ เวลา tและ ปฏิกิริยาไปข้างหน้าและย้อนกลับจะเหมือนกัน ซึ่งในกรณีนี้ความเข้มข้นของสารตั้งต้นและผลิตภัณฑ์จะเท่ากัน ดังนั้น ความสมดุลจึงไม่เคลื่อนไปด้านใดด้านหนึ่ง ความเข้มข้นของปฏิกิริยาทั้งสองจะเท่ากัน ดังที่แสดงด้านล่าง:
อย่าเพิ่งหยุด... มีมากขึ้นหลังจากโฆษณา ;)
กรณีที่ 2: ความเข้มข้นของรีเอเจนต์มากกว่าความเข้มข้นของผลิตภัณฑ์:
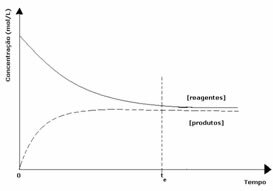
ในกรณีนี้ จะสังเกตได้ว่าเมื่อเข้าสู่สภาวะสมดุล ความเข้มข้นของสารตั้งต้นจะมากกว่าความเข้มข้นของผลิตภัณฑ์ ดังนั้นจึงสรุปได้ว่าหากมีสารตั้งต้นมากขึ้น ปฏิกิริยาผกผันจะเกิดขึ้นด้วยความเข้มข้นที่มากขึ้น ปฏิกิริยาถูกเลื่อนไปทางซ้าย:
กรณีที่ 3: ความเข้มข้นของผลิตภัณฑ์มากกว่าตัวทำปฏิกิริยา:
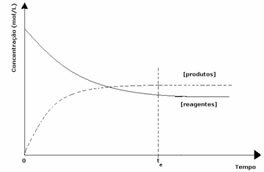
เนื่องจากความเข้มข้นของผลิตภัณฑ์ที่สมดุลมากขึ้น ซึ่งหมายความว่าปฏิกิริยาคือ เลื่อนไปทางขวาเพราะปฏิกิริยาโดยตรง (กับการก่อตัวของผลิตภัณฑ์) เกิดขึ้นมากกว่า ความเข้ม
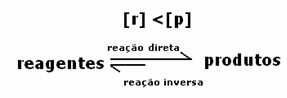
สิ่งที่จะระบุว่าปฏิกิริยามีแนวโน้มไปทางขวาหรือทางซ้ายจะเป็นค่าคงที่สมดุล K ซึ่งขึ้นอยู่กับอุณหภูมิเท่านั้น
โดย เจนนิเฟอร์ โฟกาซา
จบเคมี
ทีมโรงเรียนบราซิล
คุณต้องการอ้างอิงข้อความนี้ในโรงเรียนหรืองานวิชาการหรือไม่ ดู:
โฟกาซ่า, เจนนิเฟอร์ โรชา วาร์กัส "การศึกษากราฟิกของสมดุลเคมี"; โรงเรียนบราซิล. มีจำหน่ายใน: https://brasilescola.uol.com.br/quimica/estudo-grafico-equilibrio-quimico.htm. เข้าถึงเมื่อ 28 มิถุนายน 2021.
เคมี

ทดสอบความรู้ของคุณและเรียนรู้เพิ่มเติมด้วยรายการแบบฝึกหัดที่แก้ไขแล้วเกี่ยวกับความสมดุลทางเคมี ด้วยเนื้อหานี้ คุณจะสามารถเข้าใจวิธีการทำงานของค่าคงที่สมดุล (Kp, Kc และ Ki) ได้ดีขึ้น การเลื่อนสมดุล pH และ pOH ตลอดจนสมดุลในสารละลายบัฟเฟอร์ที่เรียกว่า