สูตรโครงสร้างเป็นวิธีการแสดงพันธะระหว่างธาตุ โดยอิเล็กตรอนแต่ละคู่ใช้ร่วมกันระหว่างอะตอมสองอะตอมที่มีเครื่องหมายเส้นประ:
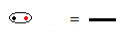
คู่อิเล็กตรอนที่ใช้ร่วมกันซึ่งมีสัญลักษณ์เป็นเส้นประ
ซึ่งหมายความว่าพันธะโควาเลนต์ทุกประเภทปรากฏในสูตรโครงสร้าง ไม่ว่าจะเป็นแบบเดี่ยว แบบคู่ หรือแบบสามเท่า:
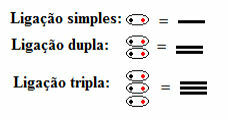
พันธะเดี่ยว พันธะคู่ และพันธะสาม ที่มีเครื่องหมายขีดคั่นในสูตรโครงสร้าง
ดูตัวอย่างบางส่วนของสูตรโครงสร้างโมเลกุลขนาดเล็กที่มีพันธะไม่กี่ชนิด และสังเกตว่ามีการแสดงคู่อิเล็กตรอนร่วมกันอย่างไร
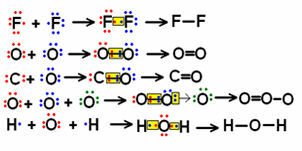
ตัวอย่างสูตรโครงสร้างสำหรับโมเลกุลบางชนิด
สูตรที่แสดงด้านบนซ้ายซึ่งคู่อิเล็กทรอนิกส์มีสัญลักษณ์เป็น "จุด" เรียกว่า สูตรอิเล็กทรอนิกส์ หรือ สูตรลูอิส. โมเลกุลเหล่านี้ทั้งหมดเป็นสารอนินทรีย์ แต่สูตรโครงสร้างมักใช้ในกรณีของสารประกอบอินทรีย์ ซึ่ง คือธาตุที่เกิดจากธาตุคาร์บอนซึ่งไม่มีแหล่งกำเนิดแร่ (เช่นในกรณีของคาร์บอนมอนอกไซด์ (CO) ซึ่งถือว่า อนินทรีย์)
เนื่องจากคาร์บอนเป็นเตตระวาเลนต์ (ทำให้เกิดพันธะโควาเลนต์สี่พันธะ) จึงมีพันธะขนาดใหญ่ ความสามารถในการจับกับอะตอมและคาร์บอนอื่น ๆ ทำให้เกิดเป็นสายโซ่อนันต์ คาร์บอนิก นั่นคือเหตุผลที่สูตรโครงสร้างมีความสำคัญเพราะบ่งบอกถึงการเรียงตัวของอะตอมในสายโซ่
เพื่อให้เข้าใจ พิจารณาสิ่งต่อไปนี้: a สูตรโมเลกุล ระบุเฉพาะจำนวนของแต่ละองค์ประกอบในโมเลกุลของสาร ตัวอย่างเช่น สมมุติว่าเรามีสูตรโมเลกุล C3โฮ6เรารู้แล้วว่ามันมีคาร์บอนสามอะตอมและไฮโดรเจนหกอะตอม แต่พวกมันถูกผูกมัดอย่างไร? สูตรโครงสร้างจะบอกเราสิ่งนี้ และเราสามารถหาได้ว่ามันคือสารประกอบใด สังเกตด้านล่างว่าสูตรโมเลกุลนี้สามารถก่อให้เกิดสูตรโครงสร้างที่แตกต่างกันสองสูตร และด้วยเหตุนี้ จึงมีสารสองชนิดที่แตกต่างกัน:

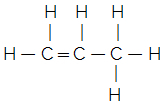
ไซโคลโพรเพน โพรพีน
เหล่านี้เรียกว่าสูตรโครงสร้างเรียบซึ่งการเชื่อมต่อและองค์ประกอบทั้งหมดจะถูกวาดบนระนาบของกระดาษ กระดานดำ หน้าจอคอมพิวเตอร์ ฯลฯ
อย่าเพิ่งหยุด... มีมากขึ้นหลังจากโฆษณา ;)
อย่างไรก็ตาม โซ่คาร์บอนจำนวนมากมีขนาดใหญ่และค่อนข้างซับซ้อน ดังนั้นจึงเป็นเรื่องยากที่จะต้องเขียนสูตรโครงสร้างให้เรียบทุกครั้ง
ดังนั้นรูปแบบอื่น ๆ ของการแสดงโครงสร้างของโมเลกุลจึงถูกสร้างขึ้นที่ง่ายขึ้น ที่แรกก็คือ สูตรโครงสร้างแบบย่อหรือแบบย่อซึ่งปริมาณไฮโดรเจนอะตอมที่ติดอยู่กับคาร์บอนแต่ละชนิดย่อโดยใส่สัญลักษณ์ (H) เพียงครั้งเดียวแล้วบวกดัชนีที่มุมล่างขวาซึ่งเป็นตัวเลขที่แสดงจำนวนไฮโดรเจน มี.
ตัวอย่างเช่น พิจารณาสูตรโครงสร้างเรียบของอีเทอร์ทั่วไป:
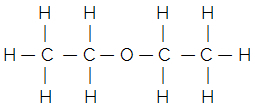
สูตรโครงสร้างแบบย่อหรือแบบย่อได้มาจาก:
โฮ3C — CH2 — โอ — CH2 — CH3
ง่ายกว่ามากใช่มั้ย!
แต่เมื่อรู้ว่าคาร์บอนสร้างพันธะสี่พันธะเสมอ และไฮโดรเจนสร้างพันธะเพียงพันธะเดียว จึงเกิดสูตรที่ง่ายกว่าอีกอย่างหนึ่งซึ่งก็คือสูตรของเส้นประ หากต้องการดูวิธีการเขียนโดยละเอียดในข้อความ สูตรโมเลกุลของสารประกอบอินทรีย์. แต่โดยพื้นฐานแล้ว ในสูตรนี้ กลุ่ม C, CH, CH จะถูกละไว้2 และ CH3ซึ่งแสดงด้วยขีดกลางที่เชื่อมต่อซิกแซก ด้านล่างเรามีสูตรโครงสร้างของอีเธอร์ดังกล่าว:
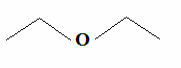
สูตร Ether Trace ทั่วไป
อย่างไรก็ตาม เป็นความจริงทีเดียวที่สูตรสารนั้นไม่แบนราบในอวกาศ ดังนั้น ในบางกรณี เพื่อให้ความคิดเชิงพื้นที่มากขึ้น พวกเขาเขียน สูตรในมุมมองโดยที่ลิงก์สามารถระบุได้ ไม่ว่าอะตอมจะอยู่ในระนาบหรือไม่ (จังหวะปกติ) หลังระนาบ (ลิ่มประ) หรือหน้าระนาบ (ลิ่มเต็ม):

การเป็นตัวแทนในสูตรในมุมมอง
ตัวอย่างเช่น ดูสูตรคอร์ติซอลด้านล่าง โปรดทราบว่าหนึ่งไฮโดรเจน หนึ่งหมู่ไฮดรอกซิล (OH) และสองหมู่เมทิล (CH .)3 ซึ่งถูกละไว้) อยู่ข้างหน้าระนาบ ขณะที่ไฮโดรเจน 2 ตัวและกลุ่มไฮดรอกซิลอยู่ด้านหลังระนาบ และส่วนที่เหลืออยู่ในระนาบ

สูตรโครงสร้างในมุมมองของคอร์ติซอล
โดย เจนนิเฟอร์ โฟกาซา
จบเคมี
สูตรเคมี สูตรโครงสร้างแบน สูตรโครงสร้างคูเปอร์ พันธะสาม แก๊ส ไนโตรเจน, สูตรอิเล็กทรอนิกส์, สูตรลิวอิส, สูตรโมเลกุล, พันธะเดี่ยว, พันธะคู่, แก๊ส คาร์บอนิก

