ขั้วของโมเลกุลเป็นสิ่งสำคัญมาก เนื่องจากคุณสมบัติของสารถูกกำหนด ท่ามกลางปัจจัยอื่น ๆ โดยข้อเท็จจริงที่ว่าโมเลกุลของพวกมันเป็นแบบมีขั้วหรือไม่มีขั้ว
การหาขั้วของโมเลกุลสามารถทำได้โดยใช้ using ช่วงเวลาไดโพล หรือ ผลลัพธ์ไดโพลโมเมนต์ซึ่งมีสัญลักษณ์คือ 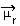 . หากเรากำลังพูดถึงโมเมนต์ไดโพลของแต่ละพันธะในโมเลกุล สัญลักษณ์ก็คือตัวอักษรกรีก mi (µ)
. หากเรากำลังพูดถึงโมเมนต์ไดโพลของแต่ละพันธะในโมเลกุล สัญลักษณ์ก็คือตัวอักษรกรีก mi (µ)

โมเลกุลจะไม่ใช่ขั้วถ้าโมเมนต์ไดโพลเท่ากับศูนย์ แต่ถ้าไม่เป็นศูนย์ แสดงว่ามีขั้ว

มีสองสิ่งสำคัญที่ต้องพิจารณาในการพิจารณาโมเมนต์ไดโพลที่เป็นผลลัพธ์นี้ มาดูกันว่าพวกเขาคืออะไร:
1) ความต่างศักย์ไฟฟ้า ระหว่างอะตอมของธาตุที่มีส่วนร่วมในปฏิกิริยา ตัวอย่างเช่น โมเลกุล HF มีความแตกต่างอย่างชัดเจนในด้านอิเล็กโตรเนกาติวีตี้ เนื่องจากฟลูออรีนดึงดูดคู่อิเล็กตรอนในพันธะมากกว่าไฮโดรเจน ดังนั้นการกระจายประจุจึงไม่สมมาตรกับไดโพลไฟฟ้า
ไดโพลนี้แสดงโดยเวกเตอร์ที่หันหน้าเข้าหาจุดสิ้นสุดที่รวมอิเล็กตรอนมากที่สุด นั่นคือ จากอะตอมที่น้อยที่สุดไปยังอะตอมที่มีอิเล็กโตรเนกาติตีมากที่สุด ดังนั้น ในกรณีนี้ เวกเตอร์ ซึ่งเป็นเวกเตอร์เดียว จะเป็นเวกเตอร์ผลลัพธ์ ดังที่แสดงด้านล่าง:
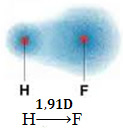
โปรดทราบว่าค่าเวกเตอร์เหมือนกับโมเมนต์ไดโพล ซึ่งกำหนดเป็นหน่วยดีบาย (D=3.33. 10
-30 คูลอมบ์ รถไฟใต้ดิน). เนื่องจากโมเมนต์ไดโพลไม่เป็นศูนย์ โมเลกุลและพันธะจึงเป็น ขั้วโลก.อย่าเพิ่งหยุด... มีมากขึ้นหลังจากโฆษณา ;)
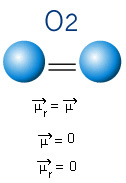
ในโมเลกุลด้านล่าง เรายังมีโมเลกุลที่มีอะตอมเพียงสองอะตอม อย่างไรก็ตาม ในกรณีนี้ มันสอดคล้องกับสารอย่างง่าย นั่นคือ มันถูกสร้างขึ้นโดยองค์ประกอบเพียงชนิดเดียวเท่านั้น ดังนั้นจึงไม่มีความแตกต่างของอิเล็กโตรเนกาติวีตี้ อะตอมยังดึงดูดอิเล็กตรอนซึ่งมีการกระจายแบบสมมาตร โมเมนต์ไดโพลที่ได้มีค่าเท่ากับศูนย์ ดังนั้นทั้งพันธะและโมเลกุลจึงเป็น โพลาร์.
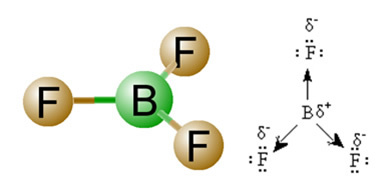
2) เรขาคณิตโมเลกุลนั่นคือการจัดเรียงเชิงพื้นที่ของเวกเตอร์ โมเลกุล BF3 มันมีพันธะสามขั้ว ซึ่งฟลูออรีนเป็นอิเล็กโตรเนกาติตีมากที่สุด จึงมีเวกเตอร์พุ่งเข้าหามัน อย่างไรก็ตาม เนื่องจากการจัดเรียงเชิงพื้นที่ของอะตอมเป็นแบบตรีโกณมิติแบน ทำให้อิเล็กตรอนมีการกระจายแบบสมมาตรรอบอะตอมกลาง ดังนั้น ผลที่ได้คือเวกเตอร์ทั้งสามนี้ตัดกันและโมเมนต์ไดโพลเท่ากับศูนย์ ดังนั้น โมเลกุล BF3 é ละอายใจ.
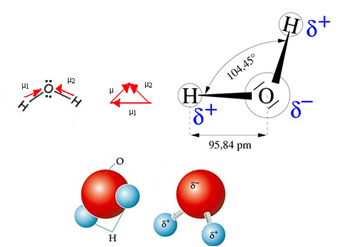
โมเลกุลของน้ำมีเวกเตอร์สองตัว อย่างไรก็ตาม เรขาคณิตเชิงพื้นที่ของมันไม่แบน แต่อยู่ในรูปของ V สังเกตในรูปต่อไปนี้ว่าด้วยวิธีนี้เวกเตอร์ของพวกมันจะไม่หักล้างซึ่งกันและกัน อิเล็กตรอนจะถูกกระจายอย่างอสมมาตรและมีความเข้มข้นมากกว่าในอะตอมที่มีไฟฟ้ามากที่สุด ซึ่งก็คือออกซิเจน ดังนั้นโมเมนต์ไดโพลจึงแตกต่างจากศูนย์และโมเลกุลของน้ำคือ ขั้วโลก:
โดย เจนนิเฟอร์ โฟกาซา
จบเคมี



