ในการศึกษาความร้อนวิทยา เราเรียกมันว่า we การแปลงแบบอะเดียแบติก การเปลี่ยนแปลงของก๊าซที่ไม่มีการแลกเปลี่ยนความร้อนกับสภาพแวดล้อมภายนอก ดังนั้น ในการแปลงแบบอะเดียแบติก ความร้อนจะเป็นศูนย์
Q = 0
หากเราใช้กฎข้อที่หนึ่งของอุณหพลศาสตร์ เรามี:
Q = ∆U+τ
∆U = - τ
แต่มันหมายความว่าไม่มีการแลกเปลี่ยนความร้อนระหว่างสภาพแวดล้อมภายนอก? หมายความว่าหากมีการขยายตัวของก๊าซและก๊าซทำงาน 300 J จะไม่ หากมีการแลกเปลี่ยนความร้อนกับตัวกลาง ความแปรผันของพลังงานภายในของก๊าซจะเป็นลบ ดังนั้น เราจะมี:
∆U = -300J
ทีนี้ ถ้าพลังงานภายในของแก๊สลดลง เราสามารถพูดได้ว่าอุณหภูมิของแก๊สก็ลดลงเช่นกัน จากกฎทั่วไปของแก๊ส

เราสามารถพูดได้ว่าถ้าปริมาตรเพิ่มขึ้นและอุณหภูมิของก๊าซลดลง ความดันก๊าซก็จะลดลงเช่นกัน โดยทั่วไป เราสามารถพูดได้ว่าสิ่งเดียวกันนี้เกิดขึ้นกับการอัด เพราะหากมีการอัด พลังงานภายในของแก๊สจะเพิ่มขึ้น ดังนั้นความดันก็จะเพิ่มขึ้นด้วย
แผนที่ความคิด: Adiabatic Transformation
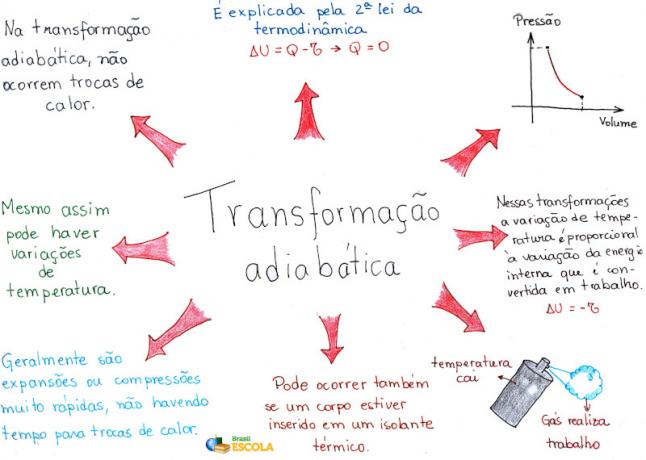
* ในการดาวน์โหลดแผนที่ความคิดในรูปแบบ PDF คลิกที่นี่!
สั้น ๆ เราสามารถพูดได้ว่า:
- ในการขยายตัวแบบอะเดียแบติก อุณหภูมิ และความดันลดลง
- ในการอัดแบบอะเดียแบติกทั้งอุณหภูมิและความดันเพิ่มขึ้น
แผนภูมิด้านล่างแสดงภาพรวมของการแปลงแบบอะเดียแบติกให้เราทราบ:
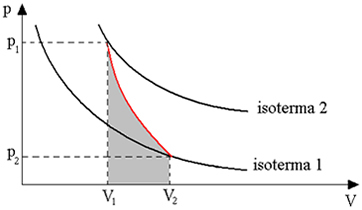
การแปลงแบบอะเดียแบติกได้มาจากการใช้ภาชนะที่หุ้มฉนวนความร้อน หรือผ่านการบีบอัดหรือการขยายตัวอย่างรวดเร็ว
ดังนั้น เราสามารถสรุปได้ว่าเมื่อก๊าซแลกเปลี่ยนความร้อนกับสภาพแวดล้อมภายนอก ความร้อนจะต้องใช้เวลาพอสมควรในการแพร่กระจายผ่านมวลก๊าซและเพื่อให้เข้าสู่สภาวะสมดุล ดังนั้น เมื่อทำการขยายและบีบอัดอย่างรวดเร็ว แทบไม่มีการแลกเปลี่ยนความร้อนกับสภาพแวดล้อมภายนอก
* แผนที่ความคิดโดยฉัน Rafael Helerbrock
โดย Domitiano Marques
จบฟิสิกส์
ที่มา: โรงเรียนบราซิล - https://brasilescola.uol.com.br/fisica/estudo-transformacao-adiabatica.htm
