อะตอม เป็นชื่อที่กำหนดให้รูปร่างของสสาร (ทุกอย่างที่มีเนื้อที่และมีมวล) ชื่อนี้เสนอโดยนักปรัชญากรีก Democritus และ Leucippus องค์ประกอบทางเคมี โมเลกุล สาร และสารอินทรีย์หรืออนินทรีย์เกิดขึ้นจากอะตอม
ในรัฐธรรมนูญ อะตอมมีอนุภาค (โปรตอน นิวตรอน และอิเล็กตรอน) ไม่ใช่ส่วนที่เล็กที่สุดของสสาร ยัง การแสดงภาพของคุณเป็นไปไม่ได้. สิ่งที่ทราบเกี่ยวกับอะตอมนั้นเกี่ยวข้องกับลักษณะทางกายภาพ เคมี และคณิตศาสตร์ที่พิสูจน์แล้วทางวิทยาศาสตร์
วิวัฒนาการของความรู้เกี่ยวกับอะตอมทำให้เกิดการพัฒนาและปรับปรุงเทคโนโลยีหลายอย่าง
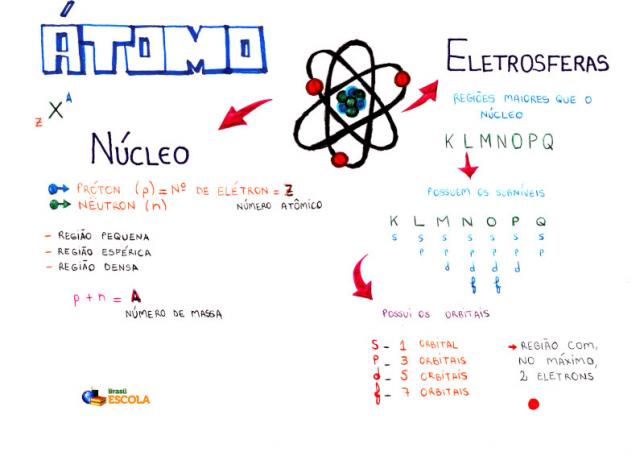
องค์ประกอบพื้นฐานของอะตอม
แกนหลัก: บริเวณอะตอมที่หนาแน่นขึ้นและถือโปรตอนและนิวตรอน
ระดับพลังงาน: บริเวณที่ล้อมรอบนิวเคลียสและบ้านที่มีระดับย่อย ออร์บิทัล และอิเล็กตรอน มีเจ็ดระดับพลังงานซึ่งแสดงด้วยตัวอักษร K, L, M, N, O, P และ Q;
ระดับย่อยของพลังงาน: คือบริเวณที่เป็นที่อยู่อาศัยของออร์บิทัล มีอยู่ในทุกระดับและแสดงด้วยตัวอักษร (s, p, d f) ปริมาณขึ้นอยู่กับแต่ละระดับ: K (มีระดับย่อย s), L (มีระดับย่อย s และ p), M (มีระดับย่อย s, p และ d), N (มีระดับย่อย s, p, d และ f), O (มีระดับย่อย s, p, d และ f), P (มีระดับย่อย s, p และ d) และ Q (มีระดับย่อย s และ ป);
ออร์บิทัลของอะตอม: บริเวณที่มีแนวโน้มจะพบอิเล็กตรอนมากที่สุด แต่ละระดับย่อยมีจำนวนออร์บิทัลต่างกัน: s (หนึ่งออร์บิทัล), p (สามออร์บิทัล), d (ห้าออร์บิทัล) และ f (เจ็ดออร์บิทัล);
โปรตอน: อนุภาคบวก (แสดงโดย p);
อิเล็กตรอน: อนุภาคลบที่มีพฤติกรรมคลื่นด้วย (แสดงโดย e)
นิวตรอน: อนุภาคที่ไม่มีประจุซึ่งลดแรงผลักระหว่างโปรตอนในนิวเคลียส (แสดงโดย n)
แผนที่ความคิด: Atom
* ในการดาวน์โหลดแผนที่ความคิดในรูปแบบ PDF คลิกที่นี่!
ตัวแทนของอะตอม
วิธีที่ง่ายที่สุดในการแสดงอะตอมคือการใช้ตัวย่อขององค์ประกอบทางเคมีที่มันก่อตัวขึ้น ตัวอย่างเช่น ตัวย่อ Se หมายถึงอะตอมทั้งหมดที่สร้างซีลีเนียมองค์ประกอบทางเคมี
ตัวย่อที่แสดงถึงอะตอมยังคงให้ข้อมูลสำคัญสองส่วน: เลขอะตอม (แสดงด้วยตัวอักษร Z และอยู่ทางด้านซ้ายเสมอ ด้านล่างของตัวย่อของอะตอม) และเลขมวล (แสดงด้วยตัวอักษร A ซึ่งสามารถวางตำแหน่งทางด้านซ้ายหรือขวาที่ด้านบนของตัวย่อของ อะตอม).
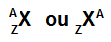
ตัวย่อของอะตอมที่มีเลขมวลและเลขอะตอม
เลขอะตอม (ซ): ระบุจำนวนโปรตอนที่มีอยู่ในนิวเคลียสของอะตอมและจำนวนอิเล็กตรอน (e) ที่มีอยู่ในระดับพลังงาน
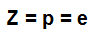
สูตรที่แสดงถึงความเป็นตัวแทนของเลขอะตอม a
จำนวนมวล (A): ระบุมวลที่มีอยู่ในนิวเคลียสของอะตอม ซึ่งเป็นผลมาจากผลรวมของจำนวนโปรตอน (p) และจำนวนนิวตรอน (n)

สูตรที่แสดงถึงความเป็นตัวแทนของเลขมวล
ความคล้ายคลึงของอะตอม
อะตอมขององค์ประกอบทางเคมีเดียวกันหรือองค์ประกอบทางเคมีที่แตกต่างกันสามารถเปรียบเทียบได้ในแง่ของจำนวนโปรตอน อิเล็กตรอน นิวตรอน และมวล โดยจำแนกได้ดังนี้
ก) ไอโซโทป
เหล่านี้เป็นอะตอมที่มี:
เลขอะตอมเดียวกัน
จำนวนโปรตอนเท่ากัน
เลขมวลต่างกัน
จำนวนนิวตรอนต่างกัน
ตัวอย่าง:
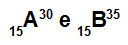
อะตอม A และ B เป็นไอโซโทป
อะตอม A และ B เป็นไอโซโทปเพราะ:
อะตอม A มี 15 โปรตอน เลขอะตอมเท่ากับ 15, 15 อิเล็กตรอน, 15 นิวตรอน และเลขมวลเท่ากับ 30
อะตอม B มี 15 โปรตอน เลขอะตอมเท่ากับ 15, 15 อิเล็กตรอน, 20 นิวตรอน และเลขมวลเท่ากับ 35
ข) ไอโซบาร์
เหล่านี้เป็นอะตอมที่มี:
เลขอะตอมต่างกัน
จำนวนโปรตอนต่างกัน
จำนวนอิเล็กตรอนต่างกัน
เลขมวลเท่ากัน
จำนวนนิวตรอนต่างกัน
ตัวอย่าง:
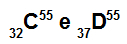
อะตอม C และ D เป็นไอโซบาร์
อะตอม C และ D เป็นไอโซบาริกเนื่องจาก:
อะตอม C มีโปรตอน 32 ตัว เลขอะตอมเท่ากับ 32, 32 อิเล็กตรอน, 23 นิวตรอน และเลขมวลเท่ากับ 55
อะตอม ดี มี 37 โปรตอน เลขอะตอมเท่ากับ 37, 37 อิเล็กตรอน, 18 นิวตรอน และเลขมวลเท่ากับ 55
ค) ไอโซโทน
เหล่านี้เป็นอะตอมที่มี:
เลขอะตอมต่างกัน
จำนวนโปรตอนต่างกัน
จำนวนอิเล็กตรอนต่างกัน
เลขมวลต่างกัน
จำนวนนิวตรอนเท่ากัน
ตัวอย่าง:
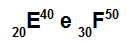
อะตอม E และ F เป็นไอโซโทป
อะตอม E และ F เป็นไอโซโทปเพราะ:
อะตอม E มี 20 โปรตอน เลขอะตอมเท่ากับ 20, 20 อิเล็กตรอน, 20 นิวตรอน และเลขมวลเท่ากับ 40
อะตอม F มี 30 โปรตอน เลขอะตอมเท่ากับ 30, 30 อิเล็กตรอน, 20 นิวตรอน และเลขมวลเท่ากับ 50
ง) ไอโซอิเล็กทรอนิกส์
เหล่านี้เป็นอะตอมที่มี:
จำนวนอิเล็กตรอนเท่ากัน
บันทึก: อะตอม isoelectronic ยังสามารถมีเลขมวลเดียวกัน (ไอโซบาร์) จำนวนนิวตรอน (ไอโซโทน) เท่ากัน หรือจำนวนโปรตอน (ไอโซโทป) เท่ากัน
ตัวอย่าง:
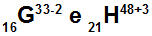
อะตอม G และ H เป็นไอโซอิเล็กทรอนิกส์
อะตอม G และ H เป็นไอโซอิเล็กทรอนิกส์เพราะ:
อะตอม G มี 16 โปรตอน เลขอะตอมเท่ากับ 16 อิเล็กตรอน 18 ตัว (เครื่องหมาย -2 แสดงว่ามีอิเล็กตรอนมากกว่าจำนวนโปรตอน 2 ตัว) 17 นิวตรอน และเลขมวลเท่ากับ 33
อะตอม H มี 21 โปรตอน เลขอะตอมเท่ากับ 21 อิเล็กตรอน 18 ตัว (เครื่องหมาย +3 แสดงว่ามีอิเล็กตรอนน้อยกว่าจำนวนโปรตอนสามตัว) 27 นิวตรอน และเลขมวลเท่ากับ 48
By Me. Diogo Lopes Dias
ที่มา: โรงเรียนบราซิล - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-atomo.htm