หนึ่งในความท้าทายที่ยิ่งใหญ่ที่สุดสำหรับทุกคนที่เรียนวิชาเคมีเรียกว่าการแจกแจงทางอิเล็กทรอนิกส์ สิ่งที่เรากำลังจะนำเสนอในบริบทนี้สามารถอำนวยความสะดวกในการศึกษาของคุณที่เกี่ยวข้องกับการกำหนดค่าอิเล็กตรอนที่เสนอโดยนักวิทยาศาสตร์ Linus Pauling ได้อย่างมาก
จำนวนอิเล็กตรอนสูงสุดที่เหมาะสมในแต่ละชั้นหรือระดับพลังงานจะได้รับผ่านตาราง:
ระดับพลังงาน จำนวนอิเล็กตรอนสูงสุด
ที่ 1 K 2
ที่ 2 L 8
3 ม. 18
ที่ 4 N 32
5° O 32
ป.18
7th Q8
ลำดับพลังงานที่เพิ่มขึ้นของระดับย่อยคือลำดับในลำดับของเส้นทแยงมุม แผนภาพ Linus Pauling แสดงอยู่ด้านล่าง:
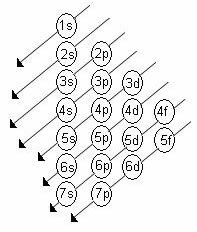
กฎพื้นฐาน:
1. เลขอะตอม (Z) ของธาตุในสถานะเป็นกลาง ระบุจำนวนอิเล็กตรอนที่จะกระจาย ตัวเลขนี้แสดงอยู่ที่ส่วนล่างซ้ายของสัญลักษณ์องค์ประกอบ
2. ใช้แผนภาพ Pauling เริ่มกระจายอิเล็กตรอนจากบนลงล่าง โดยคำนึงถึงลำดับพลังงานที่เพิ่มขึ้น (เน้นตามทิศทางของลูกศร)
3. เติมระดับย่อยด้วยระดับสูงสุดของอิเล็กตรอน หากระดับย่อยที่กำหนดมีอิเล็กตรอนเพียง 6 ตัว อย่าให้เกินจำนวนนั้น
4. ตรวจสอบจำนวนอิเล็กตรอนโดยการเพิ่มในแต่ละระดับย่อย
มาปฏิบัติกันไหม?
กระจายอิเล็กตรอนของอะตอมเหล็ก (Z=26)
ถ้าเลขอะตอมเป็น 26 แสดงว่าในอะตอมเหล็กปกติมีอิเล็กตรอน 26 ตัว ใช้ไดอะแกรม Pauling เราจะมี:

โดย Liria Alves
จบเคมี
ที่มา: โรงเรียนบราซิล - https://brasilescola.uol.com.br/quimica/regras-distribuicao-eletronica.htm
