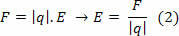แก๊สในอุดมคติ เป็นที่ที่ การชนกัน ระหว่างอนุภาคนั้นยืดหยุ่นได้ดีเยี่ยม. ระหว่างอนุภาคของเขาไม่มีปฏิสัมพันธ์ใด ๆ เช่น กองกำลัง น่าดึงดูดหรือน่ารังเกียจยิ่งกว่านั้นอนุภาคเหล่านี้ไม่ใช้พื้นที่
ให้เป็นไปตาม ทฤษฎีจลนศาสตร์ของก๊าซ gasสถานะทางอุณหพลศาสตร์ของก๊าซในอุดมคตินั้นอธิบายโดยตัวแปรของ ความดัน, ปริมาณ และ อุณหภูมิ.
ดูยัง: Calorimetry: แผนที่ความคิด สูตร และแบบฝึกหัดที่แก้ไขแล้ว
แนวคิดเกี่ยวกับก๊าซในอุดมคติ
ก๊าซในอุดมคติประกอบด้วย อนุภาคในขนาดตรงต่อเวลา (ขนาดเล็กน้อย) ที่อยู่ใน การเคลื่อนไหววุ่นวาย เปิดอยู่ สูงความเร็ว. ในก๊าซประเภทนี้ อุณหภูมิและความเร็วในการแปลของอนุภาคจะเป็นสัดส่วนกัน
เนื่องจากไม่มีปฏิสัมพันธ์ระหว่างอนุภาคของก๊าซในอุดมคติ กำลังภายใน ของก๊าซนี้จะเท่ากับผลรวมของ. เสมอ พลังงานจลน์ ของอนุภาคทั้งหมดที่ประกอบขึ้นเป็นมัน
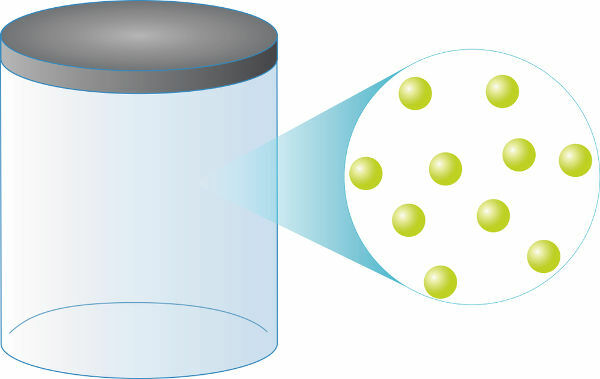
ไม่ว่าก๊าซในอุดมคติจะเป็นเช่นไร พวกมันจะมีค่าเท่ากันเสมอ จำนวนในอนุภาค สำหรับปริมาณเดียวกัน ในทางกลับกันมวลของพวกเขาจะขึ้นอยู่กับ .ของคุณโดยตรง มวลกราม (วัดเป็นกรัม/โมล) นอกจากนี้ ก๊าซในอุดมคติ 1 โมล (ประมาณ 6.0.1023 อนุภาค) จะครอบครอง a. เสมอ ปริมาตรเท่ากับ 22.4 ลิตร
คุณ ก๊าซจริง, ที่มีการเกิดของ การชนกันไม่ยืดหยุ่น ระหว่างอนุภาคเข้าใกล้พฤติกรรมของก๊าซในอุดมคติมากใน ระบบแรงดันต่ำและอุณหภูมิสูง บังเอิญภายใต้สภาวะปกติของความดันและอุณหภูมิบนโลก (25 °C และ 1 atm) ส่วนใหญ่ของ ก๊าซมีพฤติกรรมเหมือนก๊าซในอุดมคติ ซึ่งช่วยอำนวยความสะดวกในการคำนวณการคาดการณ์เกี่ยวกับพฤติกรรมทางอุณหพลศาสตร์ ของพวกเขา
ก๊าซบางชนิด เช่น ไอน้ำ, ซึ่งเจือจางใน ก๊าซในบรรยากาศ, ไม่ถือว่าเป็นก๊าซในอุดมคติ แต่ใช่ ก๊าซจริง. ก๊าซเหล่านี้มีปฏิสัมพันธ์ที่สำคัญระหว่างอนุภาคของพวกมัน ซึ่งสามารถ ย่อที่ทำให้พวกเขา causing เหลว ถ้ามี อุณหภูมิลดลง.
อย่าเพิ่งหยุด... มีมากขึ้นหลังจากโฆษณา ;)
ลักษณะของก๊าซในอุดมคติ
เข้าดูได้ที่ บทคัดย่อ, คุณลักษณะบางประการของก๊าซในอุดมคติ:
- มีเพียงการชนกันระหว่างอนุภาคที่ยืดหยุ่นอย่างสมบูรณ์เท่านั้น
- ในนั้นไม่มีปฏิสัมพันธ์ระหว่างอนุภาค
- ในนั้นอนุภาคมีขนาดเล็กน้อย
- ก๊าซในอุดมคติ 1 โมลมีปริมาตร 22.4 ลิตรโดยไม่คำนึงถึงก๊าซ
- ก๊าซจริงมีพฤติกรรมเหมือนก๊าซในอุดมคติเมื่ออยู่ภายใต้แรงดันต่ำและอุณหภูมิที่สูง
- ก๊าซส่วนใหญ่มีพฤติกรรมคล้ายกับก๊าซในอุดมคติ
กฎของแก๊สในอุดมคติ
การศึกษาก๊าซที่พัฒนาโดยนักวิชาการ ชาร์ลสบอยล์,โจเซฟหลุยส์เกย์-lussac และ โรเบิร์ตboyle นำไปสู่การเกิดขึ้นของ กฎเชิงประจักษ์สามประการใช้เพื่ออธิบายพฤติกรรมของก๊าซในอุดมคติในระบบการปกครองของ อุณหภูมิ, ความดัน และ ปริมาณค่าคงที่ ตามลำดับ
กฎหมายเหล่านี้ร่วมกันสร้างพื้นฐานที่จำเป็นสำหรับการเกิดขึ้นของ กฎของแก๊สในอุดมคติซึ่งเกี่ยวข้องกับ สถานะทางอุณหพลศาสตร์เริ่มต้นของแก๊สกำหนดโดยปริมาณ P1, T1 และ V1, กับคุณ สภาวะทางอุณหพลศาสตร์ขั้นสุดท้าย (ป2, วี2 และ T2) หลังจากที่ประสบมาบ้างแล้ว การแปลงก๊าซ.
ตรวจสอบ สูตร ของกฎหมายก๊าซทั่วไป:
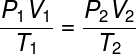
กฎแก๊สทั่วไประบุว่า states สินค้า ให้ ความดัน ขน ปริมาณของแก๊ส, หารด้วยอุณหภูมิเทอร์โมไดนามิกในหน่วยเคลวิน เท่ากับค่าคงที่ ค่าคงที่นี้จะอธิบายโดย สมการ clapeyron, ดู:
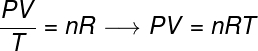
ไม่ – จำนวนโมล (โมล)
R – ค่าคงที่สากลของก๊าซสมบูรณ์ (0.082 atm.l/mol. K หรือ 8.31 จูล/โมล เค)
ในสูตรนั้น พี คือ ความดันที่เกิดจากแก๊ส วี คือปริมาตรที่ก๊าซนี้ครอบครอง และ ตู่ คืออุณหภูมิที่วัดเป็นเคลวิน ความยิ่งใหญ่ ไม่ หมายถึงจำนวนโมลในขณะที่ R คือค่าคงที่สากลของก๊าซในอุดมคติ ซึ่งมักวัดเป็นหน่วยของ atm.l/mol K หรือใน J/โมล K ซึ่งเป็นลูกบุญธรรมโดย SI.
ดูยัง:ลมสุริยะคืออะไรและส่งผลต่อชั้นบรรยากาศของโลกอย่างไร?
พลังงานภายในของก๊าซอุดมคติ
THE พลังงานภายใน ของก๊าซในอุดมคติสามารถคำนวณได้โดยใช้ผลคูณระหว่าง ค่าคงที่ในBoltzmann และอุณหภูมิทางอุณหพลศาสตร์ หมายเหตุ:
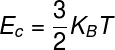
Kบี – ค่าคงที่ Boltzmann (Kบี = 1,38.10-23 เจ/เค)
จากความสัมพันธ์ครั้งก่อน ซึ่งทำให้เราสามารถคำนวณค่า พลังงานจลน์เฉลี่ย จากอนุภาคของก๊าซในอุดมคติ เราวาดสูตรต่อไปนี้ ซึ่งสามารถใช้ในการคำนวณว่า ความเร็วตารางเฉลี่ยของโมเลกุล ของก๊าซอุดมคติสำหรับอุณหภูมิ T ที่กำหนด หมายเหตุ:
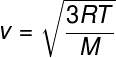
เอ็ม – มวลโมลาร์ (g/mol)
สูตรนี้ทำให้เห็นว่า a ส่วนที่เพิ่มเข้าไปที่อุณหภูมิ ของก๊าซอุดมคติ ส่งผลให้ความเร็วกำลังสองเฉลี่ยของอนุภาคเพิ่มขึ้น
เรียนรู้เพิ่มเติม:ค้นหาว่าแสงทำมาจากอะไรและมีลักษณะอย่างไร
แก้ไขแบบฝึกหัดเกี่ยวกับก๊าซในอุดมคติ
คำถามที่ 1) ก๊าซในอุดมคติสองโมลและที่ความดัน 1 atm ถูกพบที่อุณหภูมิ 227 °C คำนวณปริมาตรที่ก๊าซนี้ครอบครองเป็นลิตร
ข้อมูล: R = 0.082 atm.l/mol K
ก) 75 ลิตร
ข) 82 ลิตร
ค) 15 ลิตร
ง) 27 ลิตร
จ) 25 ลิตร
แม่แบบ: จดหมายข
ความละเอียด:
ในการคำนวณปริมาตรของก๊าซนี้ เราจะใช้สมการ Clapeyron อย่างไรก็ตาม ก่อนที่เราจะคำนวณ จำเป็นต้องเปลี่ยนอุณหภูมิ 227 °C เป็นเคลวิน สำหรับสิ่งนี้ เราเพิ่มตัวประกอบ 273 ให้กับอุณหภูมินี้ ส่งผลให้มีอุณหภูมิ 500 K
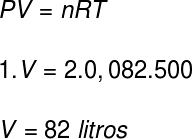
ตามความละเอียดปริมาตรที่ก๊าซครอบครองคือ 82 ลิตร
คำถามที่ 2) ก๊าซในอุดมคติมีปริมาตร 20 ลิตรเมื่ออยู่ภายใต้แรงดัน 3 atm เพื่อให้อุณหภูมิคงที่ในขณะที่ปริมาตรเพิ่มขึ้นสามเท่า คำนวณความดันสุดท้ายของก๊าซนี้หลังจากที่ผ่านการเปลี่ยนแปลงนี้
ก) 1 ตู้เอทีเอ็ม
ข) 3 ตู้เอทีเอ็ม
ค) 5 ตู้เอทีเอ็ม
ง) 8 atm
จ) 9 atm
แม่แบบ: จดหมาย
ความละเอียด:
เพื่อแก้ปัญหานี้ เราจะใช้กฎทั่วไปของแก๊ส หมายเหตุ:
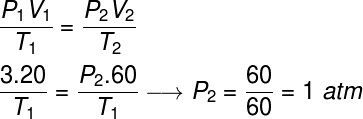
ในการคำนวณ จำเป็นต้องกำหนดปริมาตร 60 ลิตรให้กับแก๊ส เนื่องจากปริมาตรของมันเพิ่มขึ้นสามเท่าระหว่างการแปลง
โดย Rafael Hellerbrock
ครูฟิสิกส์