การแพร่กระจายและการหลั่งไหล เป็นกฎหมายสองข้อที่เสนอโดย Thomas Graham นักเคมีชาวสก็อตในศตวรรษที่ 19 โดยอิงจากการศึกษาของเขาเกี่ยวกับ ส่วนผสมของแก๊ส และพฤติกรรมของ ก๊าซ เมื่อต้องผ่านผนังภาชนะ
จากการสังเกตของ Thomas Graham เกี่ยวกับพฤติกรรมของก๊าซที่เกี่ยวข้องกับการแพร่กระจายและการไหลออก เราสามารถเน้นสิ่งต่อไปนี้:
ก๊าซมีแนวโน้มที่จะผ่านรูเล็ก ๆ ที่มีอยู่ในสสารโซลิดสเตตเสมอ
ยิ่ง มวลโมเลกุล ก๊าซยิ่งยากต่อการผ่านรูของสสารที่เป็นของแข็ง
ยิ่งความหนาแน่นของก๊าซต่ำ ความเร็วในการเคลื่อนที่ก็จะยิ่งสูงขึ้น
ยิ่งอุณหภูมิของก๊าซสูงขึ้นเท่าใด ความเร็วของแก๊สก็จะยิ่งกระจายออกสู่สิ่งแวดล้อมหรือไหลผ่านปาก
- ก๊าซจะไม่คงอยู่ ณ ตำแหน่งใดตำแหน่งหนึ่ง
การแพร่กระจาย
การแพร่กระจาย เป็นปรากฏการณ์ทางกายภาพที่ประกอบด้วยความสามารถของก๊าซในการแพร่กระจาย (นั่นคือ การแพร่กระจาย) ทั่วพื้นที่ของพื้นที่หรือภายในภาชนะ ด้วยเหตุผลนี้ เราสามารถพูดได้ว่า ภายในอวกาศ ก๊าซไม่เคยถูกจำกัดอยู่ที่ตำแหน่งเดียว

การเป็นตัวแทนของเหตุการณ์ออกอากาศ
นอกจากนี้ เราสามารถกำหนด การแพร่กระจาย ยังคงเป็นความจุที่ก๊าซหนึ่งต้องผสมกับอีกก๊าซหนึ่ง เมื่อวางในภาชนะเดียวกัน ทำให้เกิดส่วนผสมของก๊าซที่เป็นเนื้อเดียวกัน
ตัวอย่างคือเมื่อก๊าซออกมาจากท่อไอเสียรถยนต์ เป็นพิษอย่างที่เป็นอยู่ พวกมันไม่ก่อให้เกิดความเสียหายในระยะสั้นต่อมนุษย์ เนื่องจากพวกมันแพร่กระจายไปทั่วอากาศในบรรยากาศ ส่งผลให้ความเข้มข้นของพวกมันลดลง
การไหลออก
การไหลออก เป็นปรากฏการณ์ทางกายภาพที่ประกอบด้วยทางผ่านของก๊าซผ่านรูที่มีอยู่ในผนังของภาชนะหนึ่งนั่นคือประกอบด้วยทางออกของก๊าซจากสภาพแวดล้อมหนึ่งไปยังอีกที่หนึ่ง

เป็นตัวแทนของการเกิดอุทกภัย
ตัวอย่างเช่น เมื่อลูกโป่งถูกเป่าลมสำหรับงานปาร์ตี้ และในวันรุ่งขึ้น ลูกโป่งทั้งหมดก็ถูกลมพัด ทั้งหมดเป็นเพราะอากาศไหลผ่านรูที่บรรจุอยู่ในลูกโป่ง
การคำนวณที่เกี่ยวข้องกับการแพร่กระจายและการไหลออก
เราสามารถคำนวณตามสมการที่ Graham เสนอให้ ความเร็วที่ก๊าซกระทำได้ การแพร่กระจายหรือการหลั่งไหล. จากคำกล่าวของ Graham อัตราการแพร่กระจายและการไหลออกของก๊าซสองชนิดที่ผสมในภาชนะคือ แปรผกผันกับกำลังสองของความหนาแน่นสัมพัทธ์หรือมวลโมลาร์เสมอ
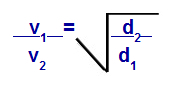
กฎของเกรแฮมเกี่ยวกับความหนาแน่น
วี1 = ความเร็ว (การไหลหรือการแพร่กระจาย) ของก๊าซ 1 ในส่วนผสม
วี2 = ความเร็ว (การไหลหรือการแพร่กระจาย) ของก๊าซ 2 ในส่วนผสม;
d1 = ความหนาแน่นของก๊าซ 1 ของส่วนผสม;
d2 = ความหนาแน่นของก๊าซ 2 ของส่วนผสม;
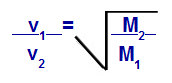
กฎของเกรแฮมเกี่ยวกับมวลกราม
วี1 = ความเร็ว (การไหลหรือการแพร่กระจาย) ของก๊าซ 1 ในส่วนผสม
วี2 = ความเร็ว (การไหลหรือการแพร่กระจาย) ของก๊าซ 2 ในส่วนผสม;
เอ็ม1 = มวลโมลาร์ของแก๊ส 1 ของส่วนผสม
เอ็ม2 = มวลโมลาร์ของแก๊ส 2 ในส่วนผสม
By Me. Diogo Lopes Dias
ที่มา: โรงเรียนบราซิล - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-difusao-efusao.htm
