หนึ่ง ปฏิกิริยาการเติม เป็นกระบวนการทางเคมีที่อะตอมของสารอนินทรีย์ถูกเติมเข้าไปในโมเลกุลอินทรีย์ ซึ่งต้องมีลักษณะอย่างใดอย่างหนึ่งดังต่อไปนี้
โครงสร้างเปิดที่มีการผูกหรือ ลิงก์ปี่;
โครงสร้างปิดอิ่มตัว (เฉพาะกับ ซิกม่าลิงค์);
โครงสร้างไม่อิ่มตัวแบบปิด (มี pi หรือพันธะอะโรมาติก)
สารประกอบอินทรีย์ที่มีคุณสมบัติเหล่านี้มีดังนี้ ไฮโดรคาร์บอน:
แอลคีน;
อัลไคเนส;
อัลคาเดียน;
ไซแคลน;
รอบ;
อะโรเมติกส์.
ระหว่าง a ปฏิกิริยาการเติม, พันธะ pi หนึ่งหรือมากกว่า หรือพันธะซิกมา (ในกรณีพิเศษของไซแคน) ถูกทำลาย ทำให้เกิดเวเลนซ์อิสระสองอันขึ้นไป (จุดเชื่อม) บนคาร์บอนที่เกี่ยวข้อง ดังในตัวอย่าง ร้อง:
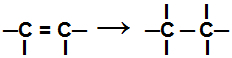
ทำลายพันธะ pi ในอัลคีน
หลังจากที่พันธะนี้แตกสลาย การเติมอะตอมจะต้องเกิดขึ้นที่ตำแหน่งพันธะใหม่ที่สร้างขึ้นในสารประกอบอินทรีย์ เราแสดงรายการด้านล่างประเภทของ below ปฏิกิริยาการเติม ที่สามารถทำได้ด้วยสารอินทรีย์
ไฮโดรจิเนชัน
ในเรื่องนี้ ปฏิกิริยาการเติมนอกจากสารประกอบอินทรีย์แล้ว สารตั้งต้นอีกชนิดหนึ่งคือก๊าซไฮโดรเจน (H2). ในแต่ละคาร์บอนที่เกิดฟิชชัน (การแตกของพันธะซิกมาหรือไพ ดังที่เคยเห็นมาก่อน) จะมีพันธะของอะตอมไฮโดรเจนที่อ้างอิงถึงปริมาณพันธะที่หัก
เมื่อเราดำเนินการไฮโดรจิเนชันของไซโคลบิวเทน เช่น พันธะซิกมาจะขาดระหว่างคาร์บอน 1 และ 2 จากนั้นอะตอมของไฮโดรเจนจะจับกับคาร์บอนแต่ละชนิด:
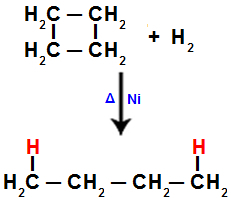
สมการแทนไฮโดรเจนในไซโคลบิวเทน
ฮาโลเจน
นอกจากสารประกอบอินทรีย์แล้ว รีเอเจนต์อื่นๆ ในส่วนนี้ ปฏิกิริยาการเติม เป็นโมเลกุลฮาโลเจน (ก๊าซคลอรีน-Cl2, ฟลูออรีน-F แก๊ส2, ไอโอดีนที่เป็นของแข็ง-I2 และโบรมีนเหลว-Br2). ที่คาร์บอนแต่ละอันที่เกิดฟิชชัน (การแตกของพันธะซิกมาหรือไพ ดังที่เห็นด้านบน) จะมีพันธะของอะตอมของ ฮาโลเจน หมายถึงจำนวนการเชื่อมต่อที่ขาด
ดังนั้น เมื่อเราดำเนินการฮาโลเจน (โดยใช้ก๊าซคลอรีน) ของไซโคลโพรพีน พันธะ pi จะขาดระหว่างคาร์บอน 1 และ 2 จากนั้นอะตอมของคลอรีนจับกับคาร์บอนแต่ละชนิด:

สมการแทนฮาโลเจนในไซโคลโพรพีน
ปฏิกิริยาการเติมด้วยเฮไลด์
เฮไลด์เป็นกรดไฮดราอนินทรีย์ที่เกิดขึ้นจากอะตอมไฮโดรเจนและอะตอมไฮโดรเจน ฮาโลเจน เช่น กรดไฮโดรคลอริก (HCl), กรดไฮโดรฟลูออริก (HF), กรดไฮโดรโบรมิก (HBr), กรด ไฮโดรโอดิกส์ (HI).
ที่ ปฏิกิริยาการเติม ด้วยเฮไลด์ นอกจากสารประกอบอินทรีย์แล้ว รีเอเจนต์อีกชนิดหนึ่งคือเฮไลด์ ดังนั้นคาร์บอนตัวหนึ่งซึ่ง การแยก (การแตกของซิกมาหรือพันธะ pi ดังที่แสดงด้านบน) จะต้องได้รับอะตอมของไฮโดรเจนและอีกอะตอมจะได้รับ เฮไลด์
ให้เป็นไปตาม กฎของมาร์คอฟนิคอฟอะตอมของคาร์บอนที่เติมไฮโดรเจนมากที่สุด (หรือคาร์บอนที่ติดอยู่กับอนุมูลที่มีขนาดเล็กกว่า) จะต้องได้รับ ไฮโดรเจนและคาร์บอนที่เติมไฮโดรเจนน้อยกว่า (หรือคาร์บอนที่ติดอยู่กับอนุมูลที่ใหญ่กว่า) จะต้องได้รับ เฮไลด์
ตัวอย่างเช่น เมื่อเราทำปฏิกิริยานี้กับโพรพีนกับกรดไฮโดรคลอริก (HCl) พันธะ pi จะขาดระหว่างคาร์บอน 1 และ 2 จากนั้นไฮโดรเจนจับกับคาร์บอน 1 (เติมไฮโดรเจนมากขึ้น) และคลอรีนจับกับคาร์บอน 2 (เติมไฮโดรเจนน้อยกว่า):
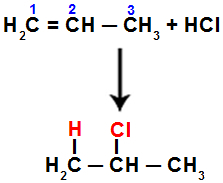
สมการแทนการเติมด้วยเฮไลด์ในโพรพีน
ปฏิกิริยาไฮเดรต
โมเลกุลของน้ำเมื่อแตกตัวเป็นไอออนจะทำให้เกิดไอออนบวกของไฮโดรเนียม (H+) และไฮดรอกไซด์แอนไอออน (OH-). ด้วยเหตุนั้น ในเรื่องนี้ ปฏิกิริยาการเติมนอกจากสารประกอบอินทรีย์แล้ว สารตั้งต้นอีกชนิดหนึ่งคือน้ำ ดังนั้นคาร์บอนตัวหนึ่งที่เกิดปฏิกิริยาฟิชชัน (การแตกของพันธะซิกมาหรือไพ ดังที่แสดงด้านบน) จะได้รับไอออนบวกของไฮโดรเนียม และอีกตัวหนึ่งได้รับไอออนของไฮดรอกไซด์
ตามกฎของ Markovnikov อะตอมของคาร์บอนที่เติมไฮโดรเจนมากที่สุด (หรือคาร์บอนที่ติดอยู่กับอนุมูลที่เล็กกว่า) จะต้องได้รับไฮโดรเนียมและคาร์บอนที่เติมไฮโดรเจนน้อยกว่า (หรือคาร์บอนที่ยึดติดกับอนุมูลที่ใหญ่กว่า) จะต้องได้รับ ไฮดรอกไซด์
เมื่อเราเติมน้ำให้เพนตา-1,4 ไดอีน ตัวอย่างเช่น พันธะ pi จะขาดระหว่างคาร์บอน 1 และ 2 และระหว่างคาร์บอน 4 และ 5 จากนั้นคาร์บอน 1 และ 5 รับไฮโดรเนียม และคาร์บอน 2 และ 4 รับไฮดรอกไซด์:
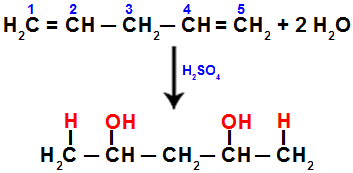
สมการแทนการเติมด้วยความชุ่มชื้นใน penta-1.4 diene
By Me. ดิโอโก้ โลเปส ดิอาส
ที่มา: โรงเรียนบราซิล - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-reacao-adicao.htm

