เกลือคู่ เป็นชื่อที่กำหนดให้หนึ่งในประเภทที่ เกลืออนินทรีย์ สามารถรับได้ การจำแนกประเภทอื่นๆ ได้แก่ แบบง่าย, สารส้ม, ไฮดรอกซิเลต, เติมไฮโดรเจน และชุ่มชื้น เพื่อให้มีลักษณะเป็นเกลือสองเท่า เกลืออนินทรีย์ต้องมีหนึ่งในชุดค่าผสมที่อธิบายไว้ด้านล่าง:
ไอออนบวก (Y) และแอนไอออนสองตัว (X และ W) และแสดงโดยสูตรต่อไปนี้:
YXW
แอนไอออน (X) และสองไอออนบวกใดๆ (Y และ Z) และแสดงโดยสูตรต่อไปนี้:
YZX
บันทึก: เกลือเหล่านี้เกิดขึ้นเมื่อ a ปฏิกิริยาการวางตัวเป็นกลาง จะดำเนินการระหว่างสอง ฐาน แตกต่างและเป็นหนึ่ง กรดหรือระหว่างกรดที่ต่างกันสองชนิดกับเบส
กฎการตั้งชื่อเกลือสองเท่า
ในการตั้งชื่อ a เกลือคู่จำเป็นต้องรู้รัฐธรรมนูญก่อนเพราะสำหรับเกลือคู่แต่ละประเภทมีกฎการตั้งชื่อเฉพาะดังที่แสดงด้านล่าง:
ก) กฎการตั้งชื่อสำหรับเกลือสองเท่าที่มีสองไพเพอร์
เมื่อหนึ่ง เกลือคู่ มีสองไพเพอร์ เราต้องใช้กฎต่อไปนี้:

กฎการตั้งชื่อที่ใช้สำหรับเกลือสองเท่าที่มีสองไพเพอร์
ต่อไปนี้คือตัวอย่างการใช้กฎการตั้งชื่อนี้สองตัวอย่าง:
ตัวอย่างที่ 1: ไลน์4ส
เกลือนี้ประกอบด้วย:
ประจุลบ: ซัลไฟด์ (S-2);
ไอออนบวกด้วยไฟฟ้าเพิ่มเติม: ลิเธียม (Li+1);
ประจุบวกด้วยไฟฟ้าน้อย: แอมโมเนียม (NH4+1).
ดังนั้นชื่อของมันก็คือลิเธียม (สองเท่า) แอมโมเนียมซัลไฟด์
ตัวอย่างที่ 2: RbCaBO3
เกลือนี้ประกอบด้วย:
ประจุลบ: borate (BO3-3);
ไอออนบวกด้วยไฟฟ้าเพิ่มเติม: รูบิเดียม (Rb+1);
ประจุบวกด้วยไฟฟ้าน้อย: แคลเซียม (Ca+2).
ดังนั้น ชื่อของมันคือบอเรต (สองเท่า) ของรูบิเดียมและแคลเซียม
b) กฎการตั้งชื่อสำหรับเกลือสองเท่าที่มีประจุลบสองตัว
เมื่อหนึ่ง เกลือคู่ มีสองแอนไอออน เราต้องใช้กฎต่อไปนี้:
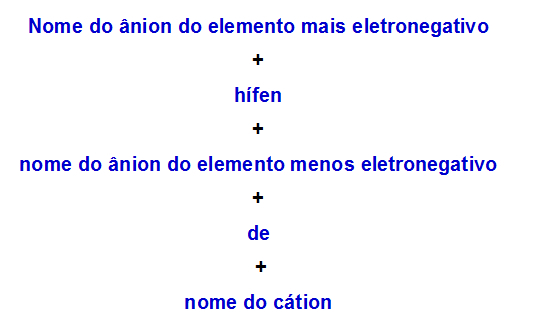
กฎการตั้งชื่อที่ใช้สำหรับเกลือสองเท่าที่มีประจุลบสองตัว
ต่อไปนี้คือตัวอย่างสองตัวอย่างในการใช้กฎนี้:
ตัวอย่างที่ 1: MgFI
เกลือนี้ประกอบด้วย:
ไอออนบวก: แมกนีเซียม (Mg+2);
แอนไอออนที่มีไฟฟ้ามากที่สุด: ฟลูออไรด์ (F-1);
ประจุลบที่มีประจุไฟฟ้าน้อย: ไอโอไดด์ (I-1).
ดังนั้นชื่อของมันก็คือแมกนีเซียมฟลูออไรด์-ไอโอไดด์
ตัวอย่างที่ 2: ZnNO2br
เกลือนี้ประกอบด้วย:
ไอออนบวก: สังกะสี (Zn+2);
ไอออนประจุลบเพิ่มเติม: ไนไตรท์ (NO2-1);
ประจุลบที่มีประจุไฟฟ้าน้อย: โบรไมด์ (Br-1).
ดังนั้นชื่อของมันก็คือซิงค์ไนไตรท์โบรไมด์
การประกอบสูตรของเกลือคู่จากการตั้งชื่อของมัน
ก) สำหรับเกลือสองเท่าที่มีสองไพเพอร์
การสร้างสูตรของ เกลือคู่ ขึ้นอยู่กับการรู้ชื่อของมัน ซึ่งเป็นมาตรฐานเช่นเดียวกับเกลือทั้งหมด นั่นคือ ประจุบวกก่อนแล้วจึงตามด้วยประจุลบ เนื่องจากเกลือคู่สามารถมีได้สองไพเพอร์ ลำดับและการจัดวางในสูตรจึงเป็นไปตามชื่อที่กำหนด
ตัวอย่างที่ 1: แบเรียม นิกเกิล ไพโรฟอสเฟต II
เกลือนี้มีฟอสเฟต (P2โอ7), แบเรียม (Ba+2) และนิกเกิล II (Ni+2) ไพเพอร์ที่เขียนในลำดับนั้น ดังนั้นสูตรของมันคือ BaNiP2โอ7.
ตัวอย่างที่ 2: ทองแดง II ฟอสเฟตและทองคำ I
เกลือนี้มีฟอสเฟต (PO4-3), ทองแดง II (Cu+2) และ ทอง ฉัน (Au+1) ไพเพอร์ที่เขียนในลำดับนั้น ดังนั้นสูตรของมันคือ CuAuPO4.
b) สำหรับเกลือสองเท่าที่มีประจุลบสองตัว
ในกรณีที่ เกลือคู่ ด้วยสองแอนไอออน เรายังทำตาม เมื่อวางแอนไอออนในสูตร ลำดับตามที่ปรากฏในชื่อที่กำหนด
ตัวอย่างที่ 1: นิกเกิลซัลเฟต-ไอโอไดด์ III
เกลือนี้มีแอนไอออนซัลเฟต (SO4-2) และไอโอไดด์ (I-1) เขียนในลำดับนี้และไอออนบวกของนิกเกิล III (Ni+3). ดังนั้นสูตรของมันคือ NiSO4ผม.
ตัวอย่างที่ 2: ตะกั่วไซยาไนด์ฟอสเฟต IV
เกลือนี้มีแอนไอออนฟอสเฟต (PO4-3) และไซยาไนด์ (CN-1) เขียนในลำดับนี้และไอออนบวก IV (Pb+4). ดังนั้นสูตรของมันคือ PbPO4ซีเอ็น.
By Me. Diogo Lopes Dias
ที่มา: โรงเรียนบราซิล - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-um-sal-duplo.htm

