คุณ ก๊าซ พวกเขาเป็น ของเหลว ซึ่งแตกต่างจากของเหลวตรงที่ใช้พื้นที่ว่างทั้งหมดของภาชนะที่พวกมันถูกจำกัด โมเลกุลที่ประกอบเป็นก๊าซมีอิสระที่จะเคลื่อนที่และมีปฏิสัมพันธ์ระหว่างกันและกับผนังของภาชนะ
อู๋ ก๊าซที่สมบูรณ์แบบหรืออุดมคติ เป็นก๊าซอุดมคติ มีลักษณะเฉพาะและสอดคล้องกับ กฎหมายแก๊สทั่วไป และ สมการของ Clapeyron
ลักษณะของก๊าซสมบูรณ์
นั่นไม่ใช่ ปฏิสัมพันธ์แรงโน้มถ่วง ระหว่างโมเลกุล
ที่ การชนกัน ในหมู่โมเลกุลคือ ยืดหยุ่นได้ดีเยี่ยมกล่าวคือมีการอนุรักษ์พลังงานจลน์ทั้งหมด
โมเลกุลแสดงการเคลื่อนไหวที่ไม่เป็นระเบียบและ ความเร็วที่ขึ้นกับค่าอุณหภูมิของแก๊สโดยตรง;
ปริมาตรที่เหมาะสมของแต่ละโมเลกุลนั้นไม่มีนัยสำคัญอย่างสมบูรณ์เมื่อเทียบกับปริมาตรรวมของก๊าซ
ตัวแปรของรัฐ
ความดัน, อุณหภูมิ และปริมาตรคือ ปริมาณทางกายภาพสเกลาร์ ที่มีลักษณะเป็นแก๊ส ปริมาณเหล่านี้เรียกว่าตัวแปรสถานะและรักษาความสัมพันธ์ของ สัดส่วน.
THE กฎของบอยล์กำหนดว่าความสัมพันธ์ระหว่างความดันและปริมาตรของก๊าซเป็นสัดส่วนผกผัน ยิ่งแรงกดดันต่อโมเลกุลมากเท่าไรก็ยิ่งใช้พื้นที่น้อยลงเท่านั้น
THE กฎหมายเกย์-ลูสแซกกำหนดว่าความสัมพันธ์ระหว่างปริมาตรและอุณหภูมิของก๊าซเป็นสัดส่วนโดยตรง
ยิ่งอุณหภูมิของแก๊สสูงขึ้น ความปั่นป่วนของโมเลกุลก็จะยิ่งมากขึ้น ซึ่งจะมีแนวโน้มแยกออกจากกัน เพิ่มพื้นที่ว่างของพวกมันกฎของชาร์ลส์ กำหนดว่าความสัมพันธ์ระหว่างความดันและอุณหภูมิของก๊าซเป็นสัดส่วนโดยตรง ยิ่งอุณหภูมิของแก๊สสูงขึ้น ความปั่นป่วนของโมเลกุลก็จะยิ่งมากขึ้น ดังนั้นอุบัติการณ์ของการชนกันระหว่างโมเลกุลกับผนังของภาชนะบรรจุจึงเพิ่มขึ้น ทำให้แรงดันของก๊าซสูงขึ้น
THE สมการ clapeyron มันสังเคราะห์กฎหมายสามข้อที่นำเสนอข้างต้นและกำหนดความสัมพันธ์เดียวระหว่างตัวแปรสถานะ
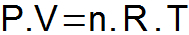
พี = แรงดันแก๊ส (atm หรือ N/m2);
วี = ปริมาณก๊าซ (L หรือ m3);
น = จำนวนโมล
ร = ค่าคงที่แก๊สสากล (0.082 atm.l/mol. K หรือ 8.31 จูล/โมล เค);
ท = อุณหภูมิแก๊ส (K)
ก๊าซในอุดมคติในธรรมชาติ
ธรรมชาติไม่ได้ผลิตก๊าซที่มีคุณสมบัติเป็นก๊าซสมบูรณ์ ก๊าซในอุดมคติคือแบบจำลองเชิงทฤษฎีและมีประโยชน์สำหรับการทำความเข้าใจพฤติกรรมของก๊าซเมื่อต้องเผชิญกับการเปลี่ยนแปลงในลักษณะของก๊าซ
โดย โยอาบ สิลาส
จบฟิสิกส์
ที่มา: โรงเรียนบราซิล - https://brasilescola.uol.com.br/o-que-e/fisica/o-que-e-gas-perfeito.htm
