ท่ามกลางความซับซ้อนของการศึกษาปรมาณูคือการกำหนดขนาดของอะตอมหรือที่ดีกว่านั้นคือ รังสีปรมาณู. คุณสมบัติเป็นระยะนี้อธิบายระยะห่างจากนิวเคลียสไปยังอิเล็กตรอนชั้นนอกสุดของระดับอิเล็กทรอนิกส์ เพื่อหาค่าเฉลี่ยเลขคณิตของระยะห่างระหว่างนิวเคลียสของอะตอมสองอะตอมที่สร้างสารอย่างง่ายเช่น
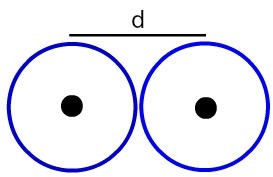
การแสดงระยะห่างระหว่างนิวเคลียสของอะตอมสองตัว
มากำหนดกัน รัศมีอะตอม (RA) ของอะตอมดังตัวอย่างในภาพ เมื่อต้องการทำสิ่งนี้ ให้แบ่งระยะห่างระหว่างแกนด้วย 2:
ร.อ. = d
2
โอ การศึกษารังสีปรมาณู มีความสำคัญเพราะช่วยให้เข้าใจเหตุการณ์ทางกายภาพบางอย่าง (ความหนาแน่น, จุดของ ฟิวชัน จุดเดือด และพลังงานไอออไนเซชัน) และสารเคมี (พันธะเคมี) ที่เกิดขึ้นกับ อะตอม
โดยการวิเคราะห์ตารางธาตุ เราสามารถประเมินว่าอะตอมมีขนาดใหญ่กว่าหรือเล็กกว่าเมื่อเทียบกับอะตอมอื่น และด้วยเหตุนี้ ตรวจสอบว่ามีความสะดวกมากหรือน้อยในการกำจัดอิเล็กตรอนหนึ่งตัวหรือมากกว่าออกจากออร์บิทัล THE การประเมินและการกำหนดรัศมีอะตอมในตารางธาตุ ดำเนินการตามเกณฑ์พื้นฐานสองประการ:
ก) จำนวนระดับพลังงาน (ครอบครัวหรือกลุ่ม/คอลัมน์แนวตั้ง)
เรารู้ว่าอะตอมสามารถมีระดับพลังงานได้ถึงเจ็ดระดับ (K, L, M, N, O, P, Q) และแต่ละระดับ องค์ประกอบทางเคมีอยู่ในตระกูลหรือกลุ่ม (คอลัมน์แนวตั้ง) และในช่วงเวลา (คอลัมน์ แนวนอน) ช่วงเวลาระบุจำนวนระดับที่อะตอมมี และตระกูลบ่งชี้ระดับย่อยที่มีพลังที่สุดของอะตอม ในกลุ่มหรือครอบครัว องค์ประกอบทางเคมีแตกต่างกันไปตามปริมาณของระดับพลังงาน ดูตารางด้านล่าง:

ยิ่งจำนวนระดับพลังงานของอะตอมมากเท่าใด รัศมีของอะตอมก็จะยิ่งมากขึ้นเท่านั้น จากการวิเคราะห์ตารางด้านบนจะเห็นได้ว่าแฟรนเซียมมีอะตอมที่ใหญ่ที่สุดเพราะมีเจ็ดระดับ ในทางกลับกัน อะตอมโพแทสเซียมมีรัศมีที่เล็กกว่าเนื่องจากมีระดับพลังงานสี่ระดับ ต่อไปนี้คือการแสดงเปรียบเทียบระหว่างอะตอมของแฟรนเซียมและอะตอมโพแทสเซียม:
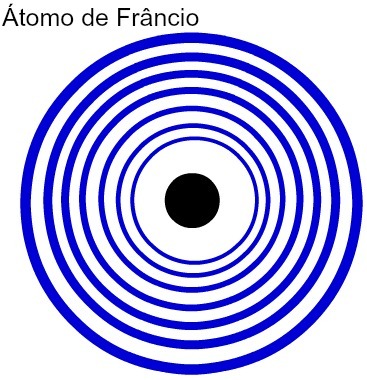
การแสดงระดับพลังงานเจ็ดระดับของอะตอมแฟรนเซียม

การแสดงระดับพลังงานทั้งสี่ของอะตอมโพแทสเซียม
แผนภาพต่อไปนี้แสดงถึงการเพิ่มขึ้นของรัศมีอะตอมในตระกูลหรือกลุ่มเดียวกัน (คอลัมน์แนวตั้ง) ของตารางธาตุ ยิ่งจำนวนชั้นมากเท่าไร รัศมีก็จะยิ่งมากขึ้น กล่าวคือ ในตารางธาตุรัศมีอะตอมจะเติบโตจากบนลงล่าง:
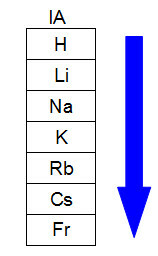
การแสดงรัศมีอะตอมที่เพิ่มขึ้นในตระกูลตารางธาตุ
b) เลขอะตอม (Z หรือจำนวนโปรตอน) ในช่วงเวลาเดียวกัน (คอลัมน์แนวนอน)
เมื่อองค์ประกอบทางเคมีอยู่ในช่วงเวลาเดียวกัน อะตอมของพวกมันจะมีระดับพลังงานเท่ากัน แต่ปริมาณโปรตอนภายในนิวเคลียสของพวกมันต่างกัน ต่อไปนี้เป็นลำดับของธาตุที่อยู่ในคาบที่สี่ของตารางธาตุ:
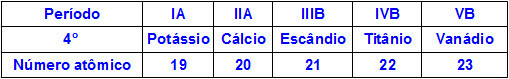
อะตอมของธาตุทั้งหมดที่แสดงในตารางด้านบนมีระดับพลังงานสี่ระดับ แต่แต่ละอะตอมมีปริมาณโปรตอนในนิวเคลียสต่างกัน ในขณะที่โปรตอนภายในนิวเคลียสออกแรงดึงดูดอิเล็กตรอนในระดับพลังงาน ยิ่งมีโปรตอนในนิวเคลียสมากเท่าไร ก็ยิ่งดึงดูดอิเล็กตรอนมากขึ้นเท่านั้น. ผลที่ได้คือค่าประมาณของระดับที่มีต่อนิวเคลียส ทำให้ขนาดของอะตอมลดลง
↑Z = ↓รัศมีอะตอม
↓Z = ↑รัศมีอะตอม
ดังนั้น เราสามารถระบุได้ว่ารัศมีอะตอมของธาตุโพแทสเซียมนั้นมากกว่ารัศมีของวาเนเดียมเนื่องจากมีโปรตอนจำนวนน้อยกว่า
แผนภาพต่อไปนี้แสดงให้เห็นว่ารัศมีอะตอมเพิ่มขึ้นในช่วงเวลาเดียวกันอย่างไร (เส้นแนวนอน) ยิ่งเลขอะตอมน้อย รัศมียิ่งมาก กล่าวคือ รัศมีอะตอมในตารางจะเพิ่มขึ้นจากขวาไปซ้าย
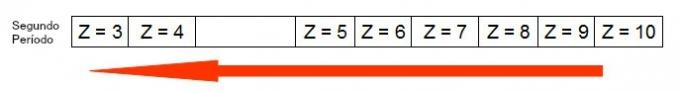
การแสดงรัศมีของอะตอมที่เพิ่มขึ้นในช่วงเวลาของตารางธาตุ
By Me. ดิโอโก้ โลเปส ดิอา

