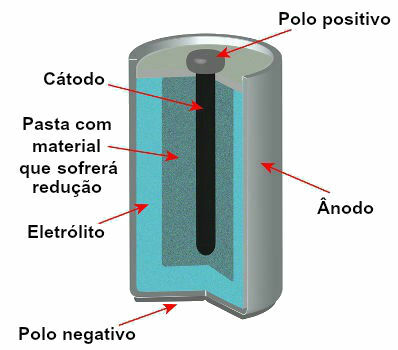
อู๋ การคำนวณศักยภาพของ a แบตเตอรี่ จะดำเนินการเมื่อคุณต้องการทราบล่วงหน้า (ก่อนประกอบ) แรงดันไฟฟ้าจะเป็นเท่าใด แรงเคลื่อนไฟฟ้า (Electromotive Force) หรือ ddp (ความต่างที่อาจเกิดขึ้น) ที่เซลล์หนึ่งๆ จะสร้างขึ้นจากโลหะสองชนิดที่มีคุณสมบัติต่างกัน
คำนี้ใช้ล่วงหน้าเพราะถ้าเราต้องการวัดแรงดันไฟฟ้าของอุปกรณ์ใด ๆ ไม่ว่าจะเป็นเซลล์หรือแบตเตอรี่ เราแค่ต้องใช้มัลติมิเตอร์
โลหะแต่ละชนิดที่มีส่วนร่วมในองค์ประกอบของแอโนดและแคโทดของเซลล์มีความแตกต่างกัน ความสามารถในการรับออกซิเดชัน (ความสามารถในการสูญเสียอิเล็กตรอน) และการลดลง (ความสามารถในการรับ อิเล็กตรอน) ความสามารถในการออกซิไดซ์หรือลดลงนี้เรียกว่าศักยภาพ ดังนั้นโลหะที่ประกอบเป็นอิเล็กโทรดของเซลล์อาจมี:
ศักยภาพในการลดมาตรฐาน (Eสีแดง): คือความจุของอิเล็กโทรดที่จะรับปรากฏการณ์การลดลง ศักย์นี้วัดเป็นโวลต์ (V) และค่าเท่ากับศักย์ออกซิเดชันมาตรฐาน แต่มีเครื่องหมายตรงข้าม
ศักย์ออกซิเดชันมาตรฐาน (Eoxy): เป็นความจุของอิเล็กโทรดที่ได้รับผลกระทบจากปรากฏการณ์ออกซิเดชัน ศักย์นี้วัดเป็นโวลต์ (V) และค่าเท่ากับค่าศักย์ไฟฟ้าลดมาตรฐาน แต่มีเครื่องหมายตรงข้าม
บันทึก: ศักย์มาตรฐานสามารถได้รับอิทธิพลจากอุณหภูมิและความเข้มข้นของสารละลายที่ใช้ในการประกอบกอง
ในการดำเนินการ การคำนวณศักยภาพของแบตเตอรี่ เราต้องรู้ค่าศักย์มาตรฐานไม่ว่าจะออกซิเดชั่นหรือรีดิวซ์และนำไปใช้ในต่อไปนี้ สมการทางคณิตศาสตร์:
ΔE = อีสีแดง (ใหญ่กว่า) - Andสีแดง (เล็กกว่า)
หรือ
ΔE = อีoxy (ใหญ่กว่า) - Andoxy (เล็กกว่า)
ΔE = ความผันแปรของศักย์ไฟฟ้าของแบตเตอรี่ (emf หรือ ddp)
สมการนี้ใช้การแปรผันที่อาจเกิดขึ้นเนื่องจากในอุปกรณ์นั้น การเกิดออกซิเดชันและการลดลง การวัดศักย์ทำได้โดยการลบศักยภาพของอิเล็กโทรดแต่ละอัน (โลหะ)
บันทึก: เราสามารถพูดได้ว่าเรากำลังทำงานกับสแต็กเมื่อ คการคำนวณผลลัพธ์ที่เป็นไปได้ในค่าบวก
กดติดตามหน่อย ตัวอย่าง ของคำถามที่กล่าวถึง คการคำนวณศักยภาพของแบตเตอรี่:
ตัวอย่างที่ 1: (UFSC-SP) รับกึ่งปฏิกิริยา:
2 เฟ+2 → 2 เฟ+3 + 2 และ Eoxy = - 0.77 V
2 Cl-1 → 1 Cl2 + 2 และ Eoxy = - 1.36V
คำนวณศักยภาพของปฏิกิริยาด้านล่าง (สแต็ก) และบอกว่าเกิดขึ้นเองหรือไม่ โดยตรวจสอบตัวเลือกที่ถูกต้อง:
2 เฟ+2 + Cl2 → 2 เฟ+3 + 2 Cl-1
ก) – 0.59V มันไม่เกิดขึ้นเอง
b) 0.59 V มันไม่เกิดขึ้นเอง
c) 0.59 V เกิดขึ้นเอง
d) – 2.13 V มันไม่เกิดขึ้นเอง
จ) 2.13 V เกิดขึ้นเอง
ความละเอียด:
ในขณะที่แบบฝึกหัดขอให้คุณกำหนดค่าศักย์ไฟฟ้าของแบตเตอรี่ เพียงวิเคราะห์ศักย์ออกซิเดชันที่จัดให้เพื่อตัดสินว่าค่าใดสูงสุดและค่าใดต่ำสุด:
2 เฟ+2 → 2 เฟ+3 + 2 และ Eoxy = - 0.77 V (อันนี้ใหญ่สุด)
2 Cl-1 → 1 Cl2 + 2 และ Eoxy = - 1.36V (อันนี้เล็กสุด)
จากนั้นเพียงนำไปใช้ในสูตรการคำนวณศักยภาพของแบตเตอรี่:
ΔE = อีoxy (ใหญ่กว่า) - Andoxy (เล็กกว่า)
ΔE = - 0.77 - (-1.36)
ΔE = - 0.77 + 1.36
ΔE = + 0.59V
เนื่องจากศักยภาพที่พบมีค่าเป็นบวก เราจึงมีกระบวนการที่เกิดขึ้นเองตามธรรมชาติ จดหมาย ค).
ตัวอย่างที่ 2: (UFMS) พิจารณากึ่งปฏิกิริยาที่แสดงด้านล่างโดยมีศักยภาพในการลดมาตรฐานตามลำดับเป็นโวลต์ (V):
Ag+ + และ → Ag Eสีแดง = 0.80V
ตูด+2 + 2 และ → Cu Eสีแดง = 0.34V
คำนวณศักยภาพของปฏิกิริยาด้านล่าง (สแต็ก) และบอกว่าเกิดขึ้นเองหรือไม่ โดยตรวจสอบตัวเลือกที่ถูกต้อง:
Cu + 2 Ag+→ คู+2 + 2 Ag
ก) – 4.6 V
ข) - 0.46 V
ค) + 0.46V
ง) + 1.14V
จ) - 1.14 V
ความละเอียด:
เนื่องจากแบบฝึกหัดขอให้คุณกำหนดมูลค่าของศักยภาพของกอง การวิเคราะห์ศักยภาพการลดลงที่จัดเตรียมไว้ให้เพื่อตัดสินว่าอันใดที่ใหญ่ที่สุดและค่าใดน้อยที่สุดก็เพียงพอแล้ว:
Ag+ + และ → Ag Eสีแดง = 0.80V (อันนี้ใหญ่สุด)
ตูด+2 + 2 และ → Cu Eสีแดง = 0.34V (อันนี้เล็กสุด)
จากนั้นเพียงนำไปใช้ในสูตรการคำนวณศักยภาพของแบตเตอรี่:
ΔE = อีสีแดง (ใหญ่กว่า) - Andสีแดง (เล็กกว่า)
ΔE = 0.80 - (0.34)
ΔE = 0.80 - 0.34
ΔE = + 0.46V
เนื่องจากศักยภาพที่พบมีค่าเป็นบวก เราจึงมีกระบวนการที่เกิดขึ้นเองตามธรรมชาติ จดหมาย ค).
By Me. Diogo Lopes Dias
ที่มา: โรงเรียนบราซิล - https://brasilescola.uol.com.br/quimica/calculo-potencial-uma-pilha.htm