พิจารณาสมดุลเคมีต่อไปนี้ที่อุณหภูมิคงที่:
3 ชั่วโมง2(ก.) + นู๋2(ก.) ↔ 2 NH3(ก.)
จากข้อมูลของ Gay-Lussac สัดส่วนของปริมาตรของผู้เข้าร่วมที่เป็นก๊าซในปฏิกิริยาจะเท่ากับอัตราส่วนของสัมประสิทธิ์ปริมาณสัมพันธ์ที่เกี่ยวข้อง พูดง่ายๆ เราสามารถพูดได้ว่าจำนวนโมเลกุลที่มีอยู่ในสารตั้งต้นและผลิตภัณฑ์เท่ากับสัมประสิทธิ์ในสมการ
ในกรณีข้างต้น ในรีเอเจนต์ เรามี 4 โมเลกุล และในผลิตภัณฑ์ เรามี 2 โมเลกุล ซึ่งหมายความว่าปริมาตรของรีเอเจนต์มากกว่าและผลิตภัณฑ์มีขนาดเล็กลง
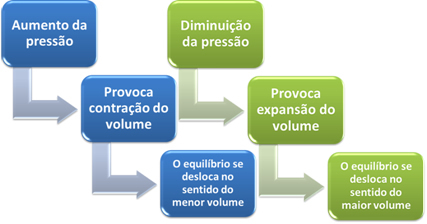
หากเราเพิ่มแรงดันในระบบนี้ เครื่องชั่งจะเลื่อนไปทางปริมาตรที่น้อยกว่าเพื่อลดแรงดันนี้ ในกรณีของปฏิกิริยาที่เรากำลังพิจารณา การกระจัดจะอยู่ในทิศทางตรงของการเกิดผลิตภัณฑ์ (NH3(ก.)).
อย่างไรก็ตาม หากเราลดความดัน ปฏิกิริยาจะเคลื่อนไปสู่ปริมาตรที่ใหญ่ที่สุดซึ่งเป็นทิศทางตรงกันข้ามของการก่อตัวของสารตั้งต้น (3 H2(ก.) + นู๋2(ก.)).
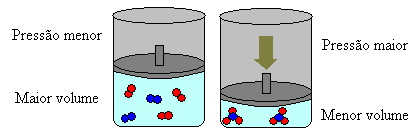
สิ่งนี้เกิดขึ้นตามหลักการของเลอ ชาเตอลิเยร์ ซึ่งกล่าวว่าการรบกวนใดๆ (เช่น การลดหรือเพิ่มความดัน) ทำให้เกิด ในระบบสมดุลจะทำให้เคลื่อนที่ไปในทิศทางที่ลดการรบกวนนี้ให้น้อยที่สุด ปรับตัวเองใหม่เป็น สมดุล.
โดยสังเขป เราสามารถพูดได้ในกรณีของอิทธิพลของการแปรผันของแรงดันที่มีต่อสมดุลทางเคมี:
ในกรณีของปฏิกิริยาซึ่งปริมาตรของสารตั้งต้นเท่ากับปริมาตรของผลิตภัณฑ์ สมดุลเคมีจะไม่เปลี่ยนแปลง
โดย เจนนิเฟอร์ โฟกาซา
จบเคมี
ที่มา: โรงเรียนบราซิล - https://brasilescola.uol.com.br/quimica/variacao-pressao-deslocamento-equilibrio-quimico.htm
