ก การระเหิด เป็นการเปลี่ยนแปลงสถานะทางกายภาพของสสารที่มีลักษณะเฉพาะโดยการผ่านโดยตรงจากเฟสของแข็งไปยังเฟสแก๊สโดยไม่ผ่านเฟสของเหลว พูดอย่างเคร่งครัด สารใด ๆ สามารถผ่านการระเหิด แต่ภายใต้เงื่อนไขเฉพาะของความดันและอุณหภูมิ การระเหิดมีความสัมพันธ์กับความดันไอในเฟสของแข็ง เช่นเดียวกับปฏิกิริยาระหว่างโมเลกุลที่กระทำโดยของแข็ง
กระบวนการนี้สามารถสังเกตได้ง่ายในน้ำแข็งแห้งซึ่งประกอบด้วยคาร์บอนไดออกไซด์ที่เป็นของแข็ง คาร์บอนไดออกไซด์จะระเหิดภายใต้ความกดดันและที่อุณหภูมิห้อง กระบวนการที่ตรงกันข้ามกับการระเหิดสามารถเรียกว่าการระเหิดใหม่หรือการทับถม เพื่อให้เกิดการระเหิด สสารต้องดูดซับพลังงาน ดังนั้นจึงถือเป็นกระบวนการดูดความร้อน
อ่านด้วย: สถานะทางกายภาพของสสารคืออะไร?
หัวข้อของบทความนี้
- 1 - สรุปเกี่ยวกับการระเหิด
- 2 - การระเหิดคืออะไร?
-
3 - การดำเนินการระเหิด
- ความดันไอคืออะไร?
- ความดันไอและการระเหิด
- แผนภาพเฟส
- 4 - ตัวอย่างของการระเหิด
- 5 - แก้ไขแบบฝึกหัดเกี่ยวกับการระเหิด
สรุปเกี่ยวกับการระเหิด
การระเหิดคือการผ่านโดยตรงจากเฟสของแข็งไปยังเฟสของก๊าซโดยไม่ต้องผ่านเฟสของเหลว
เงื่อนไขเฉพาะของความดันและอุณหภูมิเป็นสิ่งจำเป็นในการสังเกตการระเหิดของสาร
การระเหิดได้รับอิทธิพลจากลักษณะทางอุณหพลศาสตร์ เช่น ความดันไอในเฟสของแข็งและอันตรกิริยาระหว่างโมเลกุล
การระเหิดเป็นกระบวนการดูดความร้อน
ตัวอย่างของการระเหิดคือสิ่งที่เกิดขึ้นในน้ำแข็งแห้งซึ่งประกอบด้วยคาร์บอนไดออกไซด์ที่เป็นของแข็ง
การระเหิดคืออะไร?
การระเหิดคือ การเปลี่ยนโดยตรงจากเฟสของแข็งเป็นเฟสแก๊สโดยไม่ผ่านเฟสของเหลว เกิดขึ้นภายใต้เงื่อนไขเฉพาะของอุณหภูมิและความดันสำหรับของแข็งบางชนิด การเปลี่ยนแปลงนี้เป็นกระบวนการทางกายภาพของการเปลี่ยนแปลงสถานะ ไม่เกี่ยวข้องกับปฏิกิริยาเคมี
กระบวนการย้อนกลับ เช่น ทางตรงจากเฟสก๊าซไปยังเฟสของแข็ง มีชื่อเรียกต่างๆ กัน ผู้เขียนบางคนใช้คำว่า sublimation สำหรับการเปลี่ยนแปลงระยะนี้ ในขณะที่คนอื่นใช้ "resublimation" และแม้แต่ "deposition"
อย่าหยุดตอนนี้... มีเพิ่มเติมหลังจากการประชาสัมพันธ์ ;)
วิธีการทำงานของระเหิด
สามารถวาดเส้นขนานระหว่างการระเหิดและการระเหยได้ ในทั้งสองกรณี จุดสิ้นสุดคือ เฟสแก๊ส. ความแตกต่างที่เห็นได้ชัดคืออยู่ในช่วงเริ่มต้น: ของแข็งสำหรับการระเหิดและของเหลวสำหรับการระเหย
ในทั้งสองกรณี, มีอิทธิพลต่อแรงกดดัน การระเหยและลักษณะทางอุณหพลศาสตร์ที่เกี่ยวข้องกับความร้อนและอันตรกิริยาระหว่างโมเลกุล
ความดันไอคืออะไร?
ในภาชนะปิดที่บรรจุของเหลว เป็นไปได้ที่จะรับรู้ว่ามีความสมดุลระหว่างเฟสของเหลวและเฟสไอ สิ่งนี้เกิดขึ้นเนื่องจากแม้อุณหภูมิต่ำกว่าจุดเดือด พลังงานที่มีอยู่ก็เพียงพอสำหรับโมเลกุลของของเหลวที่จะแยกออกและผ่านเข้าไปในไอ อย่างไรก็ตาม โมเลกุลของไอบางชนิดยังสามารถควบแน่นอีกครั้งและกลับสู่สถานะของเหลว ซึ่งแสดงให้เห็นถึงกระบวนการย้อนกลับได้
ไอระเหยนี้ทำมาจาก สสาร (มีมวลและปริมาตร), การออกกำลังกาย ความดันบนพื้นผิวของของเหลวที่เรียกว่าความดันไอ ไม่ได้ขึ้นอยู่กับปริมาณของของเหลว แต่ขึ้นกับอุณหภูมิ เนื่องจากยิ่งอุณหภูมิสูงขึ้น โมเลกุลจะหลุดออกจากเฟสของเหลวได้ง่ายขึ้น
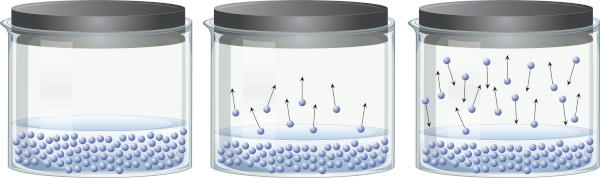
ของเหลวที่มีความดันไอสูงที่อุณหภูมิปกติเรียกว่าสารระเหย ตัวอย่างเช่น ที่ 25°C เอทิลอีเทอร์มีความดันไอ 0.58 atm อะซิโตน (โพรพาโนน) มีความดันไอ 0.29 atm ในขณะที่น้ำมีความดันไอ 0.023 atm อย่างไรก็ตาม เมื่อความดันไอเท่ากับความดันบรรยากาศ ของเหลวจะเดือด หากต้องการเรียนรู้เพิ่มเติมเกี่ยวกับความดันไอ ให้คลิก ที่นี่.
ความดันไอและการระเหิด
แม้ว่าในระดับที่น้อยกว่า ของแข็งก็มีความดันไอเช่นกันแต่ต่ำกว่าของเหลวมาก ตัวอย่างเช่น แม้ที่อุณหภูมิ 1,000 K ความดันไอของเหล็กจะอยู่ที่ 9.21 x 10 เท่านั้น-20 ATM. อย่างไรก็ตาม ของแข็งบางชนิดสามารถระเหิดได้ เช่น ไอโอดีน โดยมีความดันไอสูงกว่าที่อุณหภูมิปกติ (4 x 10-4 ATM).
สิ่งนี้เป็นไปได้ก็ต่อเมื่อมีการผ่านของโมเลกุลจากสถานะของแข็งไปยังสถานะก๊าซโดยตรง เพื่อให้สิ่งนี้เกิดขึ้น ต้องมีโมเลกุลของของแข็ง ปฏิสัมพันธ์ระหว่างโมเลกุล อ่อนแอ (ในไอโอดีน ตัวอย่างเช่น พวกมันอยู่ในประเภทไดโพลที่เหนี่ยวนำให้เกิดไดโพล)
ก็เห็นว่า กระบวนการระเหิดคือการดูดความร้อนนั่นคือ มีความจำเป็นสำหรับโมเลกุลของของแข็งในการดูดซับพลังงานในรูปของความร้อน เพื่อให้สามารถทำลายอันตรกิริยาระหว่างโมเลกุลและส่งผ่านไปยังสถานะไอ ปริมาณความร้อนที่เกี่ยวข้องสามารถวัดได้ด้วยปริมาณทางอุณหพลศาสตร์ที่เรียกว่าเอนทาลปีของการระเหิด
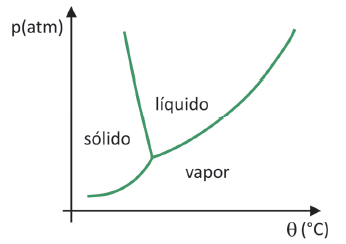
แผนภาพเฟส
ถึง เพื่อให้ทราบว่าการระเหิดของของแข็งจะเกิดขึ้นในช่วงความดันและอุณหภูมิใดคุณต้องประเมินไดอะแกรมเฟสของคุณ ลองดูกรณีของคาร์บอนไดออกไซด์ CO2.

ในเฟสไดอะแกรม เส้นแบ่งเขตระหว่างสถานะ (ของแข็ง ของเหลว และก๊าซ) นำค่าความดันและอุณหภูมิมารวมกันสำหรับ การเปลี่ยนแปลงสถานะเกิดขึ้น. เมื่อสังเกตกรณีของ CO2 จะสังเกตเห็นว่าที่ความดัน 1 บรรยากาศ เฟสของแข็งจะผ่านโดยตรงไปยังเฟสไอระเหยที่อุณหภูมิ -78.5 °C ซึ่งเป็นลักษณะของการระเหิด
คาร์บอนไดออกไซด์มีสถานะเป็นของเหลวที่ความดันสูงกว่า 5.11 บรรยากาศเท่านั้น และนอกเหนือจากความดันดังกล่าวแล้ว การระเหิดจะไม่สามารถทำได้อีกต่อไป หากต้องการเรียนรู้เพิ่มเติมเกี่ยวกับเฟสไดอะแกรม ให้คลิก ที่นี่.
ตัวอย่างของการระเหิด
น้ำแข็งแห้ง: น้ำแข็งแห้ง มักใช้ทำหมอกในงานปาร์ตี้และงานต่างๆ ที่จริงแล้วคือคาร์บอนไดออกไซด์ในสถานะของแข็ง

ลูกเหม็น: ลูกเหม็นทำจากแนฟทาลีนซึ่งเป็นสารประกอบอินทรีย์ที่มีกลิ่นหอม ใช้เพื่อขจัดกลิ่นไม่พึงประสงค์และไล่แมลงเม่า แมลงสาบ และสัตว์มีพิษอื่นๆ ซึ่งเป็นเหตุผลว่าทำไมจึงนิยมใช้ในตู้หรือแม้แต่โถฉี่

การบูร: ด้วยกลิ่นเฉพาะตัว ก้อนกรวดการบูรสามารถระเหิดได้ พวกเขายังทำหน้าที่ไล่ยุงและป้องกันเชื้อรา

ไอโอดีน: อโลหะที่เป็นของฮาโลเจนก็ผ่านการระเหิดเช่นกัน

อย่างไรก็ตาม ในบรรดาสารที่นำเสนอนั้น คาร์บอนไดออกไซด์เท่านั้นที่ระเหิดภายใต้สภาวะแวดล้อม. ส่วนอื่นๆ แม้จะระเหิดแล้ว ก็สามารถเกิดการหลอมรวมได้ตามปกติภายใต้ความกดดันที่เราอาศัยอยู่
อ่านด้วย: พลาสมา — สถานะที่สี่ของสสาร
เฉลยแบบฝึกหัดเกี่ยวกับการระเหิด
คำถามที่ 1
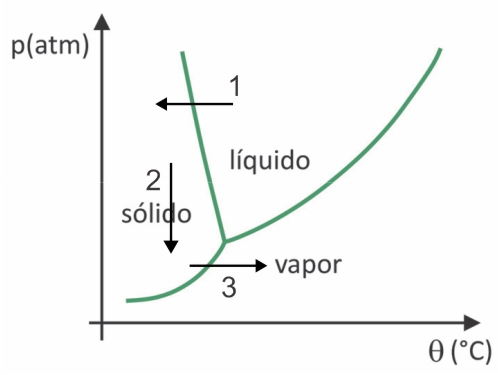
(Fuvest 2020) ในซูเปอร์มาร์เก็ต เป็นเรื่องปกติที่จะพบอาหารแห้งแช่แข็ง เช่น ผลไม้ ผัก และเนื้อสัตว์ อาหารแห้งแบบแช่เยือกแข็งยังคงเหมาะสำหรับการบริโภคเป็นเวลานาน แม้จะไม่แช่เย็นก็ตาม คำว่า "ไลโอฟิไลซ์" ในอาหารเหล่านี้หมายถึงกระบวนการแช่แข็งและการคายน้ำที่ตามมาโดยการระเหิดของน้ำ เพื่อให้น้ำระเหิดเกิดขึ้น จำเป็นต้องมีสภาวะต่างๆ ร่วมกัน ดังที่แสดงในกราฟความดัน-อุณหภูมิ โดยที่เส้นแสดงการเปลี่ยนเฟส
แม้จะเป็นกระบวนการที่ต้องใช้เทคโนโลยีบางอย่างในอุตสาหกรรม แต่ก็มีหลักฐานว่าประชาชน คนยุคก่อนโคลัมบัสที่อาศัยอยู่ในพื้นที่สูงสุดของเทือกเขาแอนดีสสามารถแช่แข็งอาหารแห้งได้ ทำให้สามารถเก็บอาหารไว้ได้ เวลามากขึ้น. ตรวจสอบทางเลือกอื่นที่อธิบายว่ากระบวนการทำแห้งโดยวิธีธรรมชาติเกิดขึ้นได้อย่างไร:
ก) การระเหิดของน้ำเกิดขึ้นเนื่องจากอุณหภูมิต่ำและความกดอากาศสูงในภูเขา
ข) อาหาร หลังจากถูกแช่แข็งโดยธรรมชาติในช่วงเวลาเย็นแล้ว ถูกนำไปยังส่วนต่ำสุดของภูเขา ซึ่งความกดอากาศต่ำกว่า ซึ่งทำให้ระเหิดได้
ค) อาหารถูกแสงแดดเพื่อเพิ่มอุณหภูมิ และความดันบรรยากาศในท้องถิ่นต่ำสนับสนุนการแข็งตัว
d) อุณหภูมิต่ำพอในช่วงที่อากาศหนาวจนแช่แข็งอาหารได้ และความดันบรรยากาศต่ำบนภูเขาสูงทำให้การระเหิดเป็นไปได้
e) อาหารหลังจากแช่แข็งตามธรรมชาติแล้ว จะถูกกดเพื่อเพิ่มความดัน จึงสามารถเกิดการระเหิดได้
การตอบสนอง: อักษร ง.
ในการทำแห้งเยือกแข็งจะมีการแช่แข็งของน้ำด้วยการระเหิดตามมา ผู้คนในยุคพรีโคลัมเบียนสามารถดำเนินกระบวนการดังกล่าวได้ เนื่องจากในฤดูหนาวน้ำอาจกลายเป็นน้ำแข็งได้ (ลูกศร 1) และด้วยความกดอากาศต่ำ (ลูกศร 2) ของบริเวณที่สูงที่สุดของเทือกเขาแอนดีส มันอาจเกิดการระเหิดได้ (ลูกศร 3).
คำถามที่ 2
(Uerj 2005) น้ำแข็งแห้งหรือคาร์บอนไดออกไซด์ที่แข็งตัวซึ่งใช้กันอย่างแพร่หลายในกระบวนการทำความเย็น ผ่านการระเหิดภายใต้สภาพแวดล้อม ในระหว่างการเปลี่ยนแปลงนี้ จะเกิดปรากฏการณ์ของการแปรผันของพลังงานและการหยุดชะงักของอันตรกิริยาระหว่างกัน
ปรากฏการณ์เหล่านี้จำแนกตามลำดับเป็น:
ก) คายความร้อน - อินเตอร์ไอออนิก
b) คายความร้อน - นิวเคลียร์
c) isothermal - อินเตอร์อะตอม
d) สารดูดความร้อน - โมเลกุล
การตอบสนอง: อักษร ง.
การระเหิดเป็นกระบวนการดูดความร้อน เนื่องจากต้องมีการดูดซับความร้อนเพื่อขัดขวางปฏิสัมพันธ์ที่ทำให้โมเลกุลของเฟสของแข็งมีขนาดกะทัดรัด ปฏิสัมพันธ์เหล่านี้เป็นประเภทระหว่างโมเลกุล
โดย Stefano Araujo Novais
ครูสอนเคมี
เรียนรู้เพิ่มเติมอย่างลึกซึ้งเกี่ยวกับปรากฏการณ์นี้
คำตอบอยู่ที่การเปลี่ยนแปลงของความดันและอุณหภูมิ
เรียนรู้เกี่ยวกับสถานะทางกายภาพของสสารและดูว่าคืออะไร เรียนรู้ด้วยว่าโบส-ไอน์สไตน์คืออะไร และพบสสารในสถานะพลาสมาได้จากที่ใด
แรงไดโพลที่เหนี่ยวนำให้เกิดไดโพลเป็นแรงระหว่างโมเลกุลที่อ่อนแอที่สุดที่เกิดขึ้นระหว่างโมเลกุลที่ไม่มีขั้ว
ดูวิธีระบุว่าสารใดมีจุดเดือดสูงกว่าอีกสารหนึ่งโดยความสัมพันธ์ระหว่างแรงระหว่างโมเลกุลกับจุดเดือด


