ส่วนผสมของก๊าซนี้ทำให้เกิดของผสมที่เป็นเนื้อเดียวกันหรือสารละลายที่เป็นก๊าซ เช่น ก๊าซที่ออกจากปล่องโรงงานหรือท่อไอเสียรถยนต์ กระจายไปในอากาศ ชั้นบรรยากาศ และเมื่อเวลาผ่านไป เราไม่สามารถแยกแยะพวกมันได้อีกต่อไป เนื่องจากมีการแพร่กระจายของก๊าซเหล่านี้ผ่านทาง อากาศ.

ก๊าซที่ปล่อยออกมาจากปล่องไฟจะกระจายและ "หายไป" ในอากาศในบรรยากาศ เนื่องจากปริมาตรของอากาศมีมากกว่าควันมาก
| NS การแพร่กระจาย ของแก๊สคือการเคลื่อนตัวของแก๊สผ่านแก๊สอื่นที่เกิดขึ้นเอง นั่นคือ การแพร่กระจายในตัวกลางที่เป็นก๊าซอีกตัวหนึ่ง |
| NS การไหลออก ของก๊าซคือการแพร่แบบเฉพาะซึ่งมีการรั่วไหลของก๊าซผ่านรูเล็กๆ (หรือผนังที่มีรูพรุนซึ่งเป็นชุดของรูเล็กๆ) |
ตัวอย่างเช่น ลูกโป่งที่ขายให้กับเด็กจะเติมก๊าซฮีเลียม เมื่อเวลาผ่านไป ก๊าซนี้จะไหลผ่านรูยางของบอลลูน กล่าวคือ มีการไหลออกของบอลลูน สิ่งนี้แสดงให้เห็นโดยข้อเท็จจริงที่ว่าบอลลูนจะปล่อยลมออกหลังจากผ่านไปสองสามชั่วโมง
Thomas Graham นักเคมีชาวสก็อตในปี 1829 ได้ศึกษาพฤติกรรมของก๊าซนี้ เขาสรุปว่าความเร็วที่ก๊าซกระจายหรือไหลออกไปในที่อื่นนั้นสัมพันธ์กับความหนาแน่นของมัน เมื่อข้อมูลการทดลองของเขาทำซ้ำสำหรับก๊าซทั้งหมด เขาได้สร้างกฎต่อไปนี้ที่มีชื่อของเขา:
กฎของเกรแฮม: อัตราการแพร่หรือการไหลออกของแก๊สแปรผกผันกับสแควร์รูทของความหนาแน่น
ในทางคณิตศาสตร์ กฎข้อนี้สามารถแสดงโดยสมการได้ดังนี้
วี α 
หรือเกี่ยวกับก๊าซสองชนิดที่ต่างกัน เรามี:
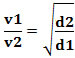
หน่วยที่ใช้ในกรณีนี้คือ "ปริมาณที่หนีออกมาต่อหน่วยเวลา"; ดังนั้นโดยทั่วไป ลิตร/นาที (ลิตรต่อนาที).
ดังนั้นก๊าซที่มีความหนาแน่นต่ำกว่าจะแพร่กระจายเร็วขึ้น หากอยู่ในอุณหภูมิและสภาวะความดันเท่ากัน คุณสามารถสร้างความสัมพันธ์ของสิ่งนี้กับมวลได้ gas molar: ยิ่งความหนาแน่นของแก๊สมากเท่าไร มวลโมเลกุลก็จะยิ่งมากขึ้น และความเร็วของแก๊สก็จะยิ่งต่ำลง การแพร่กระจาย; และในทางกลับกัน. ดังนั้นเราจึงมี:
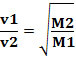
โดย เจนนิเฟอร์ โฟกาซา
จบเคมี
ทีมโรงเรียนบราซิล
แหล่งที่มา: โรงเรียนบราซิล - https://brasilescola.uol.com.br/quimica/difusao-efusao-dos-gases.htm


