การกระจายทางอิเล็กทรอนิกส์หมายถึงการกระจายอิเล็กตรอนในชั้นหรือระดับพลังงานที่ล้อมรอบนิวเคลียสของอะตอม
ตามแบบจำลองอะตอมของ Rutherford-Böhr อะตอมขององค์ประกอบทางเคมีที่รู้จักมีมากที่สุดเจ็ด ชั้นอิเล็กทรอนิกส์ ซึ่งเพิ่มพลังงานจากภายในสู่ภายนอกของแกนกลาง (1 – 2 – 3 – 4 – 5 – 6 – 7). เจ็ดชั้นเหล่านี้ยังสามารถกำหนดได้ด้วยตัวอักษร K – L – M – N – O – P – Q โดย K เป็นชั้นแรก ใกล้กับนิวเคลียสและมีพลังงานต่ำที่สุด ในทางกลับกัน ชั้น Q เป็นชั้นที่เจ็ด โดยอยู่ห่างจากแกนกลางมากที่สุดและเป็นชั้นที่มีพลังงานสูงสุด
เนื่องจากแต่ละอะตอมมีเลขอะตอม (จำนวนโปรตอนในนิวเคลียส) และจำนวนอิเล็กตรอนต่างกัน ชั้นอิเล็กตรอนของอะตอมแต่ละอะตอมมีพลังงานที่แตกต่างกันซึ่งกักเก็บอิเล็กตรอนด้วยพลังงานนั้น มุ่งมั่น.
Mind Map: การกระจายทางอิเล็กทรอนิกส์

* ในการดาวน์โหลดแผนที่ความคิดในรูปแบบ PDF คลิกที่นี่!
หมายเหตุด้านล่างอะตอมและอิเล็กตรอนบางส่วนกระจายอยู่ในชั้นอิเล็กทรอนิกส์:

อะตอมไฮโดรเจน ฮีเลียม เบริลเลียม และออกซิเจน
โปรดทราบว่าการกระจายของอะตอมของเบริลเลียมทั้งสี่คือ: 2 – 2 และออกซิเจนคือ 2 – 6 จากตัวอย่างเหล่านี้เท่านั้นจึงจะเห็นว่าการจำหน่ายทางอิเล็กทรอนิกส์เป็นไปตามคำสั่ง ตัวอย่างเช่น เปลือก K (1) สามารถมีอิเล็กตรอนได้สูงสุดสองตัว
ด้านล่างเรามีตารางที่ระบุจำนวนอิเล็กตรอนสูงสุดที่สามารถกระจายได้ในแต่ละชั้นอิเล็กทรอนิกส์:
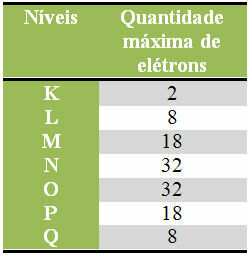
จำนวนอิเล็กตรอนสูงสุดในระดับอิเล็กทรอนิกส์
นอกจากนี้ ควรจำไว้ว่าเปลือกสุดท้ายที่จะเติม ซึ่งเรียกว่า วาเลนซ์เชลล์ ต้องมีอิเล็กตรอนสูงสุดแปดตัว ดังนั้นหากคุณกระจายอิเล็กตรอนและเห็นว่าเปลือกสุดท้ายมีปริมาณมากกว่า 8 แต่น้อยกว่า ว่า 18 แล้ว ควรจะเหลือเพียง 8 อิเล็กตรอนในเปลือกนั้นและเพิ่มส่วนที่เหลือในเปลือกถัดไป plus ภายนอก.
ตัวอย่างเช่น พิจารณาการกระจายทางอิเล็กทรอนิกส์ของอะตอมแคลเซียม เมื่อดูตารางธาตุจะพบว่ามีเลขอะตอมเท่ากับ 20 ในขณะที่ในสถานะพื้นจะมีจำนวนอิเล็กตรอนเท่ากัน ดังนั้น เราต้องกระจายอิเล็กตรอน 20 ตัวในเปลือกอิเล็กตรอนของพวกมัน ดูด้านล่าง:
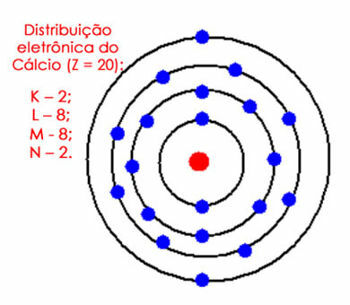
การกระจายแคลเซียมทางอิเล็กทรอนิกส์ในอะตอม
โปรดทราบว่าเปลือก M สามารถเก็บอิเล็กตรอนได้มากถึง 18 ตัว แต่ถ้าเราใส่อิเล็กตรอนที่เหลือเข้าไป มันจะมีอิเล็กตรอน 10 ตัว ซึ่งไม่สามารถเกิดขึ้นในเปลือกเวเลนซ์ได้ ดังนั้นเราจึงใส่อิเล็กตรอนอีกตัว (2) ลงในเปลือกถัดไป ซึ่งก็คือ N
แต่ถ้าจำนวนอิเล็กตรอนในเปลือกสุดท้ายอยู่ระหว่าง 18 ถึง 32 คุณจะปล่อยให้อิเล็กตรอน 18 ตัวและส่งผ่านส่วนที่เหลือไปยังเปลือกนอก ดูตัวอย่างอื่น:
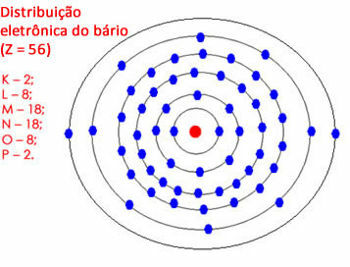
การกระจายทางอิเล็กทรอนิกส์ของแบเรียมในอะตอม
โปรดทราบว่าเปลือก "N" สามารถบรรจุอิเล็กตรอนได้สูงสุด 32 ตัว แต่ที่นี่จะมี 28 อิเล็กตรอน ดังนั้นเราจึงปล่อยให้อิเล็กตรอน 18 ตัวและส่งผ่านไปยังชั้นถัดไป แต่เปลือก “O” จะมีอิเล็กตรอน 10 ตัว เราจึงเหลือ 8 ตัวและกระจายอิเล็กตรอนที่เหลืออีก 2 ตัวไปยังเปลือก “P”
อย่างไรก็ตาม มีวิธีที่ง่ายกว่าในการกระจายอิเล็กตรอนของอะตอมแบบอิเล็กทรอนิกส์ มันผ่านการ แผนภาพ Pauling (เนื่องจากถูกสร้างขึ้นโดยนักวิทยาศาสตร์ Linus Carl Pauling (1901-1994)) หรือที่เรียกว่า แผนภาพการกระจายทางอิเล็กทรอนิกส์ หรือยัง แผนภาพระดับพลังงาน. ไดอะแกรมนี้มีลักษณะดังนี้:
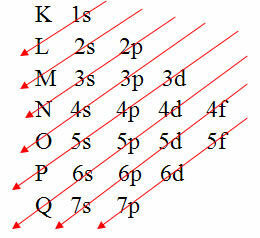
การแสดงกราฟิกของการแจกแจงทางอิเล็กทรอนิกส์ได้รับจาก Pauling Diagram
เพื่อทำความเข้าใจวิธีการแจกแจงทางอิเล็กทรอนิกส์ของอิเล็กตรอนและไอออนในแผนภาพนี้ โปรดอ่านข้อความด้านล่าง:
* การกระจายอิเล็กตรอน;
* การกระจายอิออนอิเล็กทรอนิกส์.
* เครดิตรูปภาพจาก Linus Pauling: Nobelprize.org
** Mind Map โดยฉัน Diogo Lopes
โดย เจนนิเฟอร์ โฟกาซา
จบเคมี
แหล่งที่มา: โรงเรียนบราซิล - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-distribuicao-eletronica.htm
