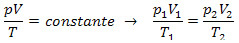อุณหพลศาสตร์เป็นสาขาวิชาฟิสิกส์ที่ศึกษาการถ่ายเทพลังงาน โดยพยายามทำความเข้าใจความสัมพันธ์ระหว่างความร้อน พลังงาน และงาน วิเคราะห์ปริมาณความร้อนที่แลกเปลี่ยนและงานที่ทำในกระบวนการทางกายภาพ
วิทยาศาสตร์อุณหพลศาสตร์ได้รับการพัฒนาขึ้นโดยนักวิจัยที่กำลังมองหาวิธีปรับปรุงเครื่องจักรในช่วงการปฏิวัติอุตสาหกรรมเพื่อเพิ่มประสิทธิภาพ
ความรู้นี้ถูกนำไปใช้ในสถานการณ์ต่างๆ ในชีวิตประจำวันของเรา ตัวอย่างเช่น: เครื่องทำความร้อนและตู้เย็น เครื่องยนต์รถยนต์และกระบวนการแปรรูปแร่ธาตุและผลิตภัณฑ์ปิโตรเลียม
กฎของอุณหพลศาสตร์
กฎพื้นฐานของอุณหพลศาสตร์ควบคุมการทำงานของความร้อนและในทางกลับกัน
กฎข้อที่หนึ่งของอุณหพลศาสตร์
THE กฎข้อที่หนึ่งของอุณหพลศาสตร์ เกี่ยวข้องกับ หลักการอนุรักษ์พลังงาน. ซึ่งหมายความว่าพลังงานในระบบไม่สามารถทำลายหรือสร้างได้ แต่จะแปลงสภาพเท่านั้น
สูตรที่แสดงถึงกฎข้อที่หนึ่งของอุณหพลศาสตร์มีดังนี้

ปริมาณความร้อน งาน และการแปรผันของพลังงานภายในมีหน่วยวัดมาตรฐานจูล (J)
ตัวอย่างเชิงปฏิบัติของการประหยัดพลังงานคือ เมื่อบุคคลใช้ปั๊มสูบลมวัตถุที่พองได้ เขากำลังใช้แรงสูบลมเข้าไปในวัตถุ ซึ่งหมายความว่าพลังงานจลน์ทำให้ลูกสูบลดลง อย่างไรก็ตาม ส่วนหนึ่งของพลังงานนี้จะถูกเปลี่ยนเป็นความร้อน ซึ่งสูญเสียไปกับสิ่งแวดล้อม
THE กฎของเฮสส์ เป็นกรณีเฉพาะของหลักการอนุรักษ์พลังงาน รู้มากขึ้น!
กฎข้อที่สองของอุณหพลศาสตร์
ที่ การถ่ายเทความร้อน พวกเขามักจะเกิดขึ้นจากร่างกายที่อบอุ่นที่สุดไปยังร่างกายที่เย็นที่สุด มันเกิดขึ้นเองตามธรรมชาติ แต่ไม่ใช่ในทางกลับกัน กล่าวคือกระบวนการถ่ายเทพลังงานความร้อนไม่สามารถย้อนกลับได้
ด้วยวิธีนี้โดย กฎข้อที่สองของอุณหพลศาสตร์ความร้อนไม่สามารถแปลงเป็นพลังงานรูปแบบอื่นได้อย่างเต็มที่ ด้วยเหตุผลนี้ ความร้อนจึงถือเป็นพลังงานรูปแบบหนึ่งที่เสื่อมโทรม

ปริมาณทางกายภาพที่เกี่ยวข้องกับกฎข้อที่สองของอุณหพลศาสตร์คือ เอนโทรปีซึ่งสอดคล้องกับระดับความผิดปกติของระบบ
อ่านด้วย:
- วงจรการ์โนต์
- การขยายตัวทางความร้อน
กฎศูนย์ของอุณหพลศาสตร์
THE กฎศูนย์ของอุณหพลศาสตร์ เกี่ยวกับเงื่อนไขในการได้รับ สมดุลความร้อน. ท่ามกลางเงื่อนไขเหล่านี้ เราสามารถพูดถึงอิทธิพลของวัสดุที่ทำให้ค่าการนำความร้อนสูงหรือต่ำได้
ตามกฎหมายนี้
- ถ้าวัตถุ A อยู่ในสภาวะสมดุลทางความร้อนเมื่อสัมผัสกับร่างกาย B และ
- ถ้าร่างกาย A นี้อยู่ในสภาวะสมดุลทางความร้อนเมื่อสัมผัสกับร่างกาย C แล้ว
- B อยู่ในสภาวะสมดุลทางความร้อนเมื่อสัมผัสกับ C
เมื่อสองร่างที่มีอุณหภูมิต่างกันมาสัมผัสกัน ตัวที่อุ่นกว่าจะถ่ายเทความร้อนไปยังตัวที่เย็นกว่า ทำให้อุณหภูมิเท่ากันถึง reaching สมดุลความร้อน.
มันถูกเรียกว่ากฎศูนย์เพราะความเข้าใจของมันพิสูจน์แล้วว่าจำเป็นสำหรับกฎสองข้อแรกที่มีอยู่แล้ว นั่นคือกฎข้อที่หนึ่งและสองของอุณหพลศาสตร์
กฎข้อที่สามของอุณหพลศาสตร์
THE กฎข้อที่สามของอุณหพลศาสตร์ ปรากฏว่าเป็นความพยายามที่จะสร้างจุดอ้างอิงที่แน่นอนที่กำหนดเอนโทรปี เอนโทรปีเป็นพื้นฐานของกฎข้อที่สองของอุณหพลศาสตร์
Walther Nernst นักฟิสิกส์ผู้เสนอแนวคิดนี้ สรุปว่าเป็นไปไม่ได้ที่สารบริสุทธิ์ที่มีอุณหภูมิเป็นศูนย์จะมีเอนโทรปีอยู่ที่ค่าประมาณศูนย์
ด้วยเหตุนี้ จึงเป็นกฎข้อขัดแย้ง ซึ่งนักฟิสิกส์หลายคนมองว่าเป็นกฎ ไม่ใช่กฎหมาย
ระบบอุณหพลศาสตร์
ในระบบอุณหพลศาสตร์ อาจมีวัตถุหนึ่งหรือหลายวัตถุที่เกี่ยวข้องกัน สภาพแวดล้อมที่ล้อมรอบมันและจักรวาลเป็นตัวแทนของสภาพแวดล้อมภายนอกระบบ ระบบสามารถกำหนดเป็น: เปิด ปิด หรือแยก
 ระบบอุณหพลศาสตร์
ระบบอุณหพลศาสตร์
เมื่อเปิดระบบจะมีการถ่ายโอนมวลและพลังงานระหว่างระบบกับสภาพแวดล้อมภายนอก ในระบบปิดมีเพียงการถ่ายเทพลังงาน (ความร้อน) และเมื่อแยกออกจะไม่มีการแลกเปลี่ยน
พฤติกรรมของก๊าซ
พฤติกรรมด้วยกล้องจุลทรรศน์ของก๊าซสามารถอธิบายและตีความได้ง่ายกว่าในสถานะทางกายภาพอื่น ๆ (ของเหลวและของแข็ง) นั่นเป็นเหตุผลที่ก๊าซถูกใช้มากที่สุดในการศึกษาเหล่านี้
ในการศึกษาทางอุณหพลศาสตร์จะใช้ก๊าซในอุดมคติหรือก๊าซสมบูรณ์แบบ เป็นแบบจำลองที่อนุภาคเคลื่อนที่อย่างไม่เป็นระเบียบและมีปฏิสัมพันธ์เฉพาะในการชนกันเท่านั้น นอกจากนี้ ยังถือว่าการชนกันระหว่างอนุภาคและระหว่างอนุภาคกับผนังของภาชนะนั้นมีความยืดหยุ่นและคงอยู่ได้ในเวลาอันสั้น
ในระบบปิด ก๊าซในอุดมคติจะสมมติพฤติกรรมที่เกี่ยวข้องกับปริมาณทางกายภาพต่อไปนี้: ความดัน ปริมาตร และอุณหภูมิ ตัวแปรเหล่านี้กำหนดสถานะทางอุณหพลศาสตร์ของก๊าซ
 พฤติกรรมของก๊าซตามกฎของแก๊ส
พฤติกรรมของก๊าซตามกฎของแก๊ส
แรงดัน (p) เกิดจากการเคลื่อนที่ของอนุภาคก๊าซภายในภาชนะ พื้นที่ที่ก๊าซบรรจุอยู่ในภาชนะคือปริมาตร (v) และอุณหภูมิ (t) สัมพันธ์กับพลังงานจลน์เฉลี่ยของอนุภาคก๊าซที่เคลื่อนที่
อ่านด้วยนะ กฎหมายแก๊ส และ การศึกษาก๊าซ.
กำลังภายใน
พลังงานภายในของระบบคือปริมาณทางกายภาพที่ช่วยในการวัดว่าการเปลี่ยนแปลงของก๊าซเกิดขึ้นได้อย่างไร ขนาดนี้สัมพันธ์กับการแปรผันของอุณหภูมิและพลังงานจลน์ของอนุภาค
ก๊าซในอุดมคติที่ประกอบด้วยอะตอมเพียงชนิดเดียว มีพลังงานภายในเป็นสัดส่วนโดยตรงกับอุณหภูมิของก๊าซ นี่แสดงโดยสูตรต่อไปนี้:

แก้ไขแบบฝึกหัดเกี่ยวกับอุณหพลศาสตร์
คำถามที่ 1
กระบอกสูบที่มีลูกสูบเคลื่อนที่ได้บรรจุก๊าซที่ความดัน 4.0.104N/m2. เมื่อจ่ายความร้อนให้กับระบบ 6 kJ ที่ความดันคงที่ ปริมาตรของแก๊สจะเพิ่มขึ้น 1.0.10-1ม3. กำหนดงานที่ทำและการเปลี่ยนแปลงของพลังงานภายในในสถานการณ์นี้
คำตอบที่ถูกต้อง: งานที่ทำคือ 4000 J และการเปลี่ยนแปลงพลังงานภายในคือ 2000 J
ข้อมูล:
พี = 4,0.104 N/m2
คิว = 6KJ หรือ 6000J
ΔV = 1,0.10-1 ม3
ท =? ΔU = ?
ขั้นตอนที่ 1 คำนวณงานด้วยข้อมูลปัญหา
ท = ป. ΔV
T = 4.0.104. 1,0.10-1
T = 4000 J
ขั้นตอนที่ 2: คำนวณความแปรผันของพลังงานภายในด้วยข้อมูลใหม่
Q = T + ΔU
ΔU = Q - T
ΔU = 6000 - 4000
ΔU = 2000J
ดังนั้นงานที่ทำคือ 4000 J และการเปลี่ยนแปลงพลังงานภายในคือ 2000 J
คำถาม2
(ดัดแปลงจาก ENEM 2011) มอเตอร์สามารถทำงานได้ก็ต่อเมื่อได้รับพลังงานจากระบบอื่นในปริมาณหนึ่งเท่านั้น ในกรณีนี้ พลังงานที่เก็บไว้ในเชื้อเพลิงส่วนหนึ่งจะถูกปล่อยออกมาระหว่างการเผาไหม้ เพื่อให้เครื่องสามารถทำงานได้ เมื่อเครื่องยนต์ทำงาน พลังงานบางส่วนที่แปลงหรือแปลงในการเผาไหม้จะไม่สามารถใช้งานได้ ซึ่งหมายความว่ามีการรั่วไหลของพลังงานในรูปแบบอื่น
ตามข้อความ การเปลี่ยนแปลงพลังงานที่เกิดขึ้นระหว่างการทำงานของเครื่องยนต์นั้นเกิดจาก:
ก) การปล่อยความร้อนภายในเครื่องยนต์เป็นไปไม่ได้
b) การทำงานของเครื่องยนต์นั้นไม่สามารถควบคุมได้
c) การแปลงความร้อนให้ทำงานเต็มที่เป็นไปไม่ได้
d) การแปลงพลังงานความร้อนเป็นจลนศาสตร์เป็นไปไม่ได้
จ) การใช้พลังงานที่อาจเกิดขึ้นของเชื้อเพลิงนั้นไม่สามารถควบคุมได้
ทางเลือกที่ถูกต้อง: c) การแปลงความร้อนเป็นการทำงานอย่างสมบูรณ์เป็นไปไม่ได้
อย่างที่เห็นก่อนหน้านี้ ความร้อนไม่สามารถแปลงเป็นงานได้เต็มที่ ระหว่างการทำงานของมอเตอร์ พลังงานความร้อนบางส่วนจะสูญเสียไปและถูกถ่ายโอนไปยังสภาพแวดล้อมภายนอก
ดูด้วย: แบบฝึกหัดเกี่ยวกับอุณหพลศาสตร์