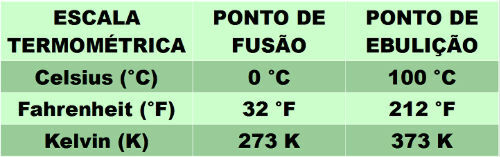
เพื่อให้คุณเข้าใจปรากฏการณ์ของ ไอออไนซ์ ก่อนอื่นต้องรู้ว่าไอออนคืออะไร สังเกตคำอธิบายด้านล่าง:
ทุกอะตอมมีจำนวนโปรตอนและอิเล็กตรอนเท่ากัน ดังนั้นทุกอะตอมจึงเป็นกลางทางไฟฟ้า นอกจากนี้ สารที่เกิดจากกลุ่มของอะตอมยังมีประจุไฟฟ้าที่สมดุล เป็นกลางทางไฟฟ้า
อย่างไรก็ตามอะตอมหรือกลุ่มของอะตอมสามารถสูญเสียหรือได้รับอิเล็กตรอน เมื่อสิ่งนั้นเกิดขึ้น พวกมันจะสูญเสียความเป็นกลางและกลายเป็นไอออน
หากอะตอมหรือหมู่อะตอมสูญเสียอิเล็กตรอนไปจะมีประจุบวกและจะกลายเป็นไอออนที่เรียกว่า ไอออนบวก. อย่างไรก็ตาม หากคุณได้รับอิเล็กตรอน ประจุจะเป็นลบ และไอออนจะเป็น a ประจุลบ.
สารอนินทรีย์เป็นไอออนิกหรือมีความสามารถในการสร้างไอออน
วิธีหนึ่งในการสร้างไอออนคือการวางสารโมเลกุลในน้ำ ซึ่งก็คือ เกิดจากพันธะโควาเลนต์ ซึ่งอิเล็กตรอนจะถูกแบ่งใช้
ตัวอย่างเช่น หากเราทดสอบการนำไฟฟ้าของกรดไฮโดรคลอริก (HCl) ในสารละลายที่เป็นน้ำ (ไฮโดรเจนคลอไรด์) ละลายในน้ำ) เราจะเห็นว่าสารละลายเป็นอิเล็กโทรไลต์ นั่นคือ นำกระแสไฟฟ้า เพราะมีไอออนอยู่ในนี้ สารละลาย.

ซึ่งหมายความว่าน้ำทำหน้าที่เป็นสารตั้งต้นสร้างไอออนจากกรดไฮโดรคลอริก สิ่งนี้เกิดขึ้นตามปฏิกิริยาด้านล่าง:
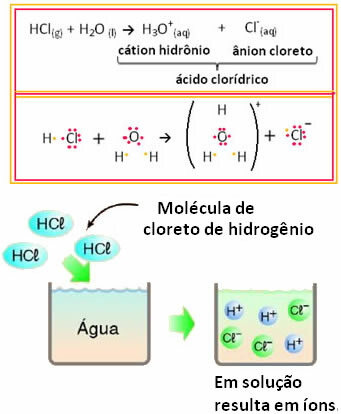
สังเกตว่าก่อนที่จะใส่ไฮโดรเจนคลอไรด์ลงในน้ำ ไม่มีอิออน อย่างไรก็ตาม โมเลกุลของมันทำปฏิกิริยากับน้ำและเกิดไอออน H บวก3โอ+ (ไพเพอร์) และลบ Cl- (แอนไอออน). เนื่องจากคลอรีนมีอิเล็กโตรเนกาติตีมากกว่าไฮโดรเจน จึงดึงดูดคู่อิเล็กตรอนจากพันธะโควาเลนต์ที่อยู่ใกล้ๆ และสร้างประจุลบ ไฮโดรเจนถูกดึงดูดโดยออกซิเจนในน้ำซึ่งมีอิเล็กโตรเนกาติตีมากกว่าคลอรีน และระหว่างไฮโดรเจนกับออกซิเจนจะเกิดพันธะโควาเลนต์ขึ้น ทำให้เกิดไฮโดรเนียมไอออนบวก ปรากฏการณ์นี้เรียกว่าไอออไนซ์.
จากคำอธิบายข้างต้น เราสามารถกำหนดไอออไนซ์ได้ดังนี้:

โปรดทราบว่าไอออนไม่เคยมีอยู่มาก่อน เพราะหากมีอยู่จริง เช่นในกรณีของการละลายของสารประกอบไอออนิก เราจะมีการแยกตัวของไอออนิกและไม่ใช่การแตกตัวเป็นไอออน
กรดทั้งหมดที่สัมผัสกับน้ำจะได้รับการแตกตัวเป็นไอออน อย่างไรก็ตาม ไม่ใช่ว่าทุกสารประกอบของโมเลกุลจะผ่านการแตกตัวเป็นไอออนตัวอย่างเช่น น้ำตาล (C12โฮ22โอ11) เป็นโมเลกุล อย่างไรก็ตาม เมื่อวางในน้ำ ไม่มีอิออนเกิดขึ้น มันแค่ละลาย ทำให้เกิดสารละลายโมเลกุลที่ไม่ใช่อิเล็กโทรไลต์ ซึ่งไม่นำไฟฟ้า
โดย เจนนิเฟอร์ โฟกาซา
จบเคมี