ไฮโดรคาร์บอนเรียกอีกอย่างว่า ไฮโดรเจนคาร์ไบด์เป็นสารประกอบอินทรีย์ที่มีองค์ประกอบเพียงอะตอมของ คาร์บอน (C) และจาก ไฮโดรเจน (H) จึงมีสูตรทั่วไป Cxโฮy.
ไฮโดรคาร์บอนประกอบด้วยโครงสร้างคาร์บอนที่อะตอมของไฮโดรเจนยึดติดใน พันธะโควาเลนต์.
เป็นสารประกอบที่สำคัญที่สุดในเคมีอินทรีย์
ไฮโดรคาร์บอนทุกชนิดออกซิไดซ์ได้ง่ายจึงปล่อยความร้อน ส่วนใหญ่ไม่ละลายน้ำ
ไฮโดรคาร์บอนธรรมชาติเป็นสารประกอบทางเคมีที่เกิดขึ้นภายในโลก (มากกว่า 150 กม. จาก ลึก) ที่ความกดอากาศสูงและบริเวณเข้าถึงของความกดอากาศต่ำผ่านกระบวนการทางธรณีวิทยา
ไฮโดรคาร์บอนพบได้ที่ไหน?
แหล่งที่มาหลักของไฮโดรคาร์บอนคือน้ำมัน ด้วยเหตุนี้ไฮโดรคาร์บอนจึงมีอยู่ในอนุพันธ์หลายอย่างเช่น such น้ำมันก๊าด, พาราฟิน, ก๊าซธรรมชาติ, น้ำมันเบนซิน, วาสลีน, น้ำมันดีเซล, แอลพีจี (ก๊าซปิโตรเลียมเหลว) โพลีเมอร์ (เช่นพลาสติกและยาง) เป็นต้น
สารประกอบอินทรีย์นี้คิดเป็น 48% ของเมทริกซ์พลังงานของบราซิล
ห่วงโซ่คาร์บอนที่ประกอบเป็นส่วนหนึ่งขององค์ประกอบของไฮโดรคาร์บอนคือ เตตระวาเลนต์กล่าวคือสามารถสร้างการเชื่อมต่อได้สี่แบบ
คาร์บอนสามารถจับกับอะตอมของคาร์บอนอื่น ๆ และกับไฮโดรเจนได้ผ่าน ลิงค์ง่ายๆ, คู่ double หรือ สามเท่า.
การจำแนกประเภทของไฮโดรคาร์บอน
การจำแนกประเภทของไฮโดรคาร์บอนขึ้นอยู่กับความจำเพาะสามประการ: a แบบฟอร์ม ของห่วงโซ่คาร์บอนหลัก the การเชื่อมต่อ ของโซ่คาร์บอน การปรากฏตัวของอนุมูลอัลคิล ในห่วงโซ่คาร์บอนและ การปรากฏตัวของเฮเทอโรอะตอม แบ่งห่วงโซ่คาร์บอน
เรียนรู้เพิ่มเติมเกี่ยวกับ ไฮโดรเจน.
รูปร่างโซ่คาร์บอนหลัก
สำหรับรูปร่างของห่วงโซ่คาร์บอนหลัก การจำแนกประเภทของไฮโดรคาร์บอนแบ่งออกเป็น อะลิฟาติก และ วัฏจักร.
ตรวจสอบว่าห่วงโซ่คาร์บอนแต่ละรูปแบบประกอบด้วยอะไรบ้าง
อะลิฟาติกไฮโดรคาร์บอน
อะลิฟาติกไฮโดรคาร์บอนเกิดจากสายโซ่คาร์บอน เปิด หรือ acyclic. ในสายโซ่เหล่านี้ คาร์บอนเป็นขั้ว
ตัวอย่าง:
ด่าง
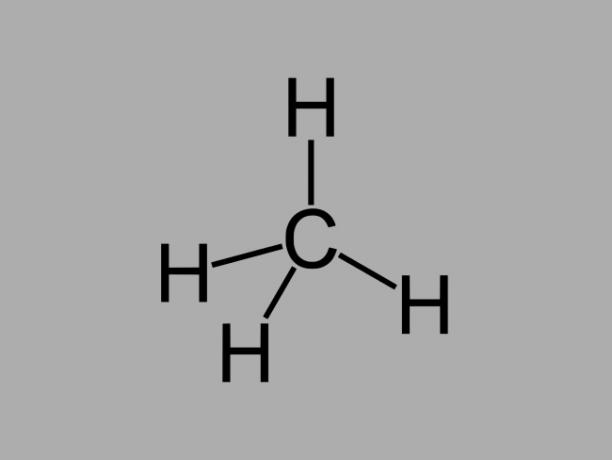
ไฮโดรคาร์บอนอัลเคนหรือเรียกอีกอย่างว่า พาราฟิน หรือ พาราฟินเป็นสารประกอบมันที่มีพันธะเดี่ยวระหว่างคาร์บอน
สูตรทั่วไปสำหรับอัลเคนคือ Cไม่H2ไม่ + 2 (n = จำนวนเต็มใดๆ)
แอลคีน
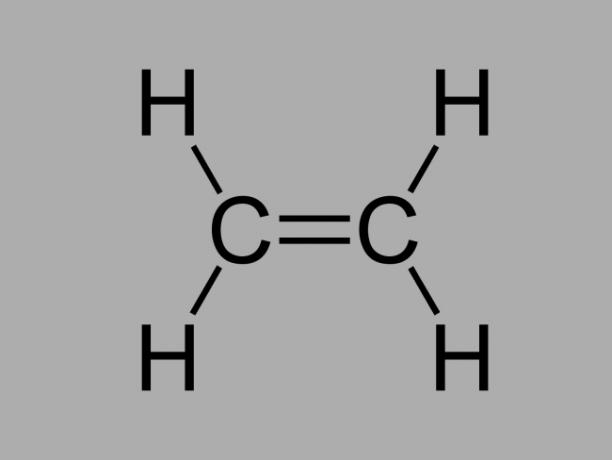
เรียกอีกอย่างว่า โอเลฟิน, แอลคีน หรือ เอทิลีนไฮโดรคาร์บอน, แอลคีนเป็นสารประกอบที่มีปฏิกิริยาต่ำซึ่งมีพันธะคู่ระหว่างคาร์บอน
สูตรทั่วไปของแอลคีนคือ Cไม่H2ไม่.
อัลคีน
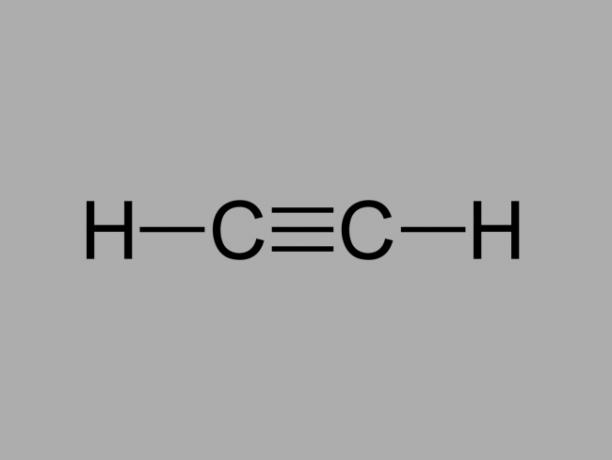
เรียกอีกอย่างว่า เมทิลอะเซทิลีน, อัลไคน์เป็นไฮโดรคาร์บอนที่มีพันธะระหว่างคาร์บอนเป็นสามเท่า
สูตรทั่วไปสำหรับอัลไคน์คือ Cไม่H2ไม่-2.
ด่างadi

เรียกอีกอย่างว่า dienes หรือ diolefins อัลคาเดียนเป็นไฮโดรคาร์บอนที่พันธะระหว่างคาร์บอนเป็นสองเท่า
สูตรทั่วไปสำหรับอัลคาเดียนคือ Cไม่H2ไม่-2.
ไซคลิกไฮโดรคาร์บอน
ไซคลิกไฮโดรคาร์บอนเกิดขึ้นจากโซ่คาร์บอนแบบปิดหรือแบบไซคลิก โซ่เหล่านี้ไม่มีขั้วคาร์บอน
ตัวอย่าง:
Cyclan
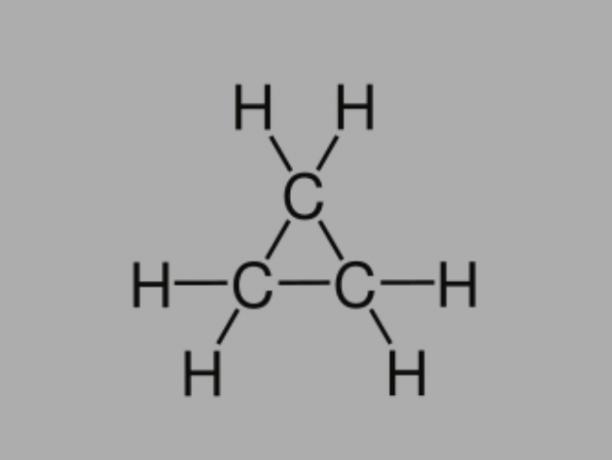
เรียกอีกอย่างว่า ไซโคลอัลเคน, ไซโคลพาราฟิน หรือ แนฟเทนิกไฮโดรคาร์บอน, ไซเคนเป็นไฮโดรคาร์บอนอิ่มตัว ประกอบด้วยพันธะเดี่ยว
มีโซ่คาร์บอนปิดและมีสูตรทั่วไปคือ Cไม่H2ไม่.
ไซโคลน

เรียกอีกอย่างว่า ไซโคลแอลคีน, ไซเคิลเป็นไฮโดรคาร์บอนไม่อิ่มตัว ประกอบด้วยพันธะคู่
ไซเคิลมีโซ่คาร์บอนปิดและสูตรทั่วไปคือ Cไม่H2ไม่−2.
นักปั่นจักรยาน
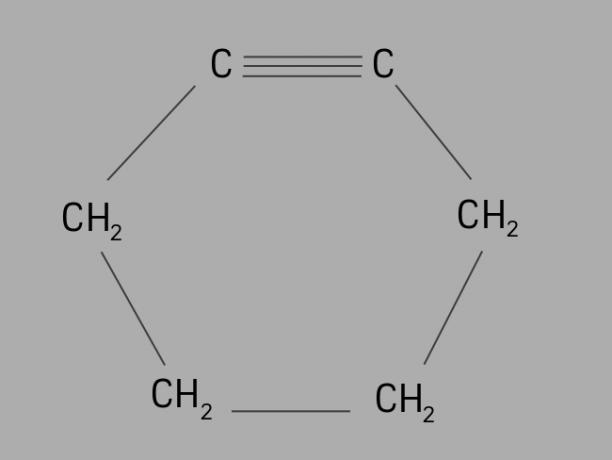
เรียกอีกอย่างว่า ไซโคลอัลไคน์ หรือ ไซโคลอัลไคน์, ไซคลินเป็นไฮโดรคาร์บอนที่เป็นวัฏจักรและไม่อิ่มตัว
เกิดจากโซ่คาร์บอนปิด มีพันธะสามตัว และมีสูตรทั่วไปคือ Cไม่H2ไม่-4.
กลิ่นหอม

หรือ

เรียกอีกอย่างว่า สนามกีฬา, อะโรมาติกไฮโดรคาร์บอนเป็นสารประกอบไม่อิ่มตัวที่เกิดจากพันธะคู่
อะโรมาติกมีโซ่คาร์บอนแบบปิดหรือแบบวน และสูตรทั่วไปคือ C6โฮ6.
ประเภทของพันธะของโซ่คาร์บอน
ขึ้นอยู่กับชนิดของการเชื่อมโยงของโซ่คาร์บอน ไฮโดรคาร์บอนสามารถจำแนกได้เป็น อิ่มตัว หรือ ไม่อิ่มตัว.
ดูด้านล่างว่าแต่ละหมวดหมู่ประกอบด้วยอะไรบ้าง
ไฮโดรคาร์บอนอิ่มตัว
ไฮโดรคาร์บอนอิ่มตัวเกิดจาก ลิงค์ง่ายๆ.
ตัวอย่าง: แอลเคน, ไซแคน.
ไฮโดรคาร์บอนไม่อิ่มตัว
ไฮโดรคาร์บอนไม่อิ่มตัวเกิดจาก พันธะคู่ หรือ สามเท่า.
ตัวอย่าง: แอลคีน, แอลไคน์, แอลคาเดียน.
การปรากฏตัวของอนุมูลอัลคิล
เกี่ยวกับการมีอยู่ของอัลคิลเรดิคัล ไฮโดรคาร์บอนสามารถมีสายโซ่คาร์บอนได้ ปกติ หรือ แตกแขนง.
โซ่คาร์บอนธรรมดา
ไฮโดรคาร์บอนสายโซ่คาร์บอนปกติไม่มีอัลคิลเรดิคัล
ตัวอย่าง: เพนเทน
ห่วงโซ่คาร์บอนแตกแขนง
เมื่อไฮโดรคาร์บอนมีสายโซ่คาร์บอนแบบแยกแขนง แสดงว่าสายโซ่คาร์บอนหลักมีอัลคิลเรดิคัล
ตัวอย่าง: เมทิลโพรเพน
การมีอยู่ของเฮเทอโรอะตอมที่แบ่งสายโซ่คาร์บอน
สายโซ่คาร์บอนแบบเรียงตามลำดับอาจจะแยกหรือไม่ก็ได้ขึ้นอยู่กับการมีอยู่ของเฮเทอโรอะตอม
ห่วงโซ่คาร์บอนที่เป็นเนื้อเดียวกัน
เมื่อไฮโดรคาร์บอนมีโซ่คาร์บอนหลักที่เป็นเนื้อเดียวกัน แสดงว่าโซ่นี้ ไม่แบ่ง โดยเฮเทอโรอะตอม
ห่วงโซ่คาร์บอนต่างกัน
ถ้าไฮโดรคาร์บอนมีโซ่คาร์บอนหลักต่างกัน โซ่นี้มี แยกโซ่คาร์บอน โดยเฮเทอโรอะตอม
การตั้งชื่อไฮโดรคาร์บอน
ระบบการตั้งชื่อของไฮโดรคาร์บอนถูกกำหนดโดยการรวมกันของสามส่วน:

คำนำหน้าระบุปริมาณคาร์บอน สารกลางระบุประเภทของพันธะ และส่วนต่อท้ายระบุหน้าที่ของสารประกอบ (ในกรณีนี้คือคลาสของไฮโดรคาร์บอน)
ดูด้านล่างสำหรับรายการคำนำหน้าและสารมัธยันตร์ที่รวมกันเพื่อกำหนดไฮโดรคาร์บอน
รายการนำหน้า
| จำนวนคาร์บอน | คำนำหน้า |
|---|---|
| 1 | พบ- |
| 2 | et- |
| 3 | พร็อพ- |
| 4 | แต่- |
| 5 | ถูกคุมขัง- |
| 6 | Hex- |
| 7 | เฮป- |
| 8 | ต.ค.- |
| 9 | ไม่ใช่- |
| 10 | ธ.ค.- |
รายชื่อตัวกลาง
| ประเภทการเชื่อมต่อ | คนกลาง |
|---|---|
| โทรอย่างเดียว | -อัน- |
| คู่ | -en- |
| ทริปเปิ้ล | -ใน- |
| สองคู่ | -เดียน- |
ดูตัวอย่างการตั้งชื่อไฮโดรคาร์บอน
ตัวอย่าง:
CH3 – CH2 – CH2 – CH3
ในรูปแบบโครงสร้างด้านบน เราจะเห็นสารประกอบ 4-คาร์บอนที่มีพันธะเดี่ยวเท่านั้น (ระบุด้วยสัญลักษณ์ “–”)
- คำนำหน้าสำหรับ 4 คาร์บอน = แต่-
- ตัวกลางสำหรับการผูกเดี่ยว= -an-
- คำต่อท้ายของไฮโดรคาร์บอน= -o
เห็นว่าสหภาพของ คำนำหน้า + ระดับกลาง + คำต่อท้าย ก่อให้เกิดชื่อ บิวเทน.
CH2 = CH2
รูปแบบโครงสร้างด้านบนมีคาร์บอน 2 ตัวและพันธะคู่ 1 ตัว (ระบุด้วยสัญลักษณ์ “=”)
- คำนำหน้าสำหรับ 2 คาร์บอน = et-
- ตัวกลางสำหรับพันธะคู่= -en-
- คำต่อท้ายของไฮโดรคาร์บอน= -o
เห็นว่าสหภาพของ คำนำหน้า + ระดับกลาง + คำต่อท้าย ก่อให้เกิดชื่อ ETHENE.
CH2 = CH - CH2 – CH3
CH3 – CH = CH2 – CH3
โปรดทราบว่ารูปแบบโครงสร้างทั้งสองข้างต้นมีคาร์บอน 4 ตัวและพันธะคู่ 1 พันธะ (ระบุด้วยสัญลักษณ์ “=”)
ดังนั้นเราจึงมี:
- คำนำหน้าสำหรับ 4 คาร์บอน = แต่-
- ตัวกลางสำหรับพันธะคู่= -en-
- คำต่อท้ายของไฮโดรคาร์บอน= -o
เห็นว่าสหภาพของ คำนำหน้า + ระดับกลาง + คำต่อท้าย จะทำให้เกิดชื่อ บูทีน สำหรับโครงสร้างทั้งสองแบบ
อย่างไรก็ตาม โปรดทราบว่ารูปแบบโครงสร้างไม่เหมือนกัน ดังนั้นระบบการตั้งชื่อจึงไม่สามารถเป็นอย่างใดอย่างหนึ่งได้
ความแตกต่างระหว่างรูปแบบโครงสร้างทั้งสองแบบอยู่ที่ตำแหน่งของพันธะคู่
ในกรณีนี้ เราต้องนับคาร์บอนในห่วงโซ่จากปลายที่ใกล้ที่สุดกับสองเท่า ดังนั้น ในกรณีที่เป็นปัญหา เราต้องนับจากซ้ายไปขวา
ใน CH2 = CH - CH2 – CH3:
- CH2 จะเป็น1
- CH จะเป็น 2
- CH2 จะเป็น3
- CH3 จะเป็น4
โปรดทราบว่า พันธะคู่ อยู่ระหว่าง คาร์บอน 1 มันเป็น คาร์บอน2.
เราต้องใช้จำนวนที่น้อยที่สุด (1) เพื่อค้นหาพันธะคู่: บิวทีน -1
ใน CH3 – CH = CH2 – CH3:
- CH3 จะเป็น1
- CH จะเป็น 2
- CH2 จะเป็น3
- CH3 จะเป็น4
โปรดทราบว่าพันธะคู่อยู่ระหว่าง คาร์บอน2 มันเป็น คาร์บอน 3.
เราต้องใช้ตัวเลขที่น้อยที่สุด (2) เพื่อค้นหาพันธะคู่: BUTENE -2
ตามที่ IUPAC (สหภาพเคมีบริสุทธิ์และเคมีประยุกต์ระหว่างประเทศ – International Union of Pure and Applied Chemistry) ควรระบุตำแหน่งก่อน ตั้งอยู่ (ในกรณีของรูปแบบโครงสร้างข้างต้นพันธะคู่ซึ่งแสดงโดยตัวกลาง “-en-”).
ด้วยเหตุนี้ เรามีวิธีที่สอง ซึ่งโดยวิธีการที่ถูกต้องที่สุดในการเขียนการตั้งชื่อของรูปแบบโครงสร้างที่มีอยู่
CH2 = CH - CH2 – CH3: BUTENE -1 หรือ BUT-1-ENO (รูปแบบที่ถูกต้องมากขึ้น)
CH3 – CH = CH2 – CH3: BUTENE -2 หรือ BUT-2-ENE (รูปแบบที่ถูกต้องมากขึ้น)
ดูข้อมูลเพิ่มเติมเกี่ยวกับ IUPAC และ ระบบการตั้งชื่อ.
