ก๊าซมีคุณสมบัติสามประการที่เรียกว่าตัวแปรสถานะ ได้แก่ ความดัน ปริมาตร และอุณหภูมิ เมื่อตัวแปรเหล่านี้เปลี่ยนแปลงไปหนึ่งตัวหรือมากกว่า a การแปลงก๊าซ, ซึ่งสามารถจำแนกได้เป็นไอโซเทอร์มอล ไอโซโวลูเมตริก หรือไอโซบาริก
ถูกเรียก การเปลี่ยนแปลงอุณหภูมิ การเปลี่ยนแปลงของก๊าซซึ่ง which อุณหภูมิของระบบคงที่ รูปแบบที่เกิดขึ้นเฉพาะใน ความดัน และในปริมาตรของก๊าซ
การเปลี่ยนแปลงนี้เรียกอีกอย่างว่ากฎของบอยล์-มาริออตต์ — ชื่อที่ให้ไว้เพื่อเป็นเกียรติแก่ Boyle นักเคมีชาวไอริชซึ่งในปี ค.ศ. 1660 ได้ผ่านกฎหมายที่ระบุว่า ในตัวอย่างที่กำหนดของ แก๊สในอุดมคติ, ผลคูณของความดันและปริมาตรของก๊าซจะคงที่เมื่ออุณหภูมิไม่แปรผัน และเพื่อเป็นเกียรติแก่ Mariotte นักฟิสิกส์ชาวฝรั่งเศสผู้ค้นพบกฎเดียวกันในปี 1676 อย่างอิสระ
โดยสรุป กฎหมายที่อธิบายพฤติกรรมของก๊าซในระหว่างการแปลงสภาพด้วยอุณหภูมิความร้อนคงที่สามารถระบุได้ดังนี้
“ในการแปลงสภาพอุณหภูมิความร้อน ความดันที่กระทำโดยตัวอย่างก๊าซในอุดมคติจะเป็นสัดส่วนผกผันกับการเปลี่ยนแปลงปริมาตรของมัน”
อย่าเพิ่งหยุด... มีมากขึ้นหลังจากโฆษณา ;)
จากกฎข้อนี้ เราสามารถสรุปได้ว่าเมื่อเพิ่มแรงดันของมวลก๊าซ ปริมาณที่มันครอบครองจะลดลงและในทางกลับกัน ดังนั้นผลคูณระหว่างปริมาณทั้งสองนี้จะคงที่
ในทางคณิตศาสตร์ กฎของ Boyle-Mariotte สามารถอธิบายได้ด้วยนิพจน์:
ป. v = ค่าคงที่
เนื่องจากผลคูณระหว่างความดันและปริมาตรคงที่ เราสามารถสรุปได้ว่า:
พี1. วี1 =p2 . วี2
นอกจากนี้ กฎหมายฉบับนี้ยังแสดงเป็นภาพกราฟิกอีกด้วย:
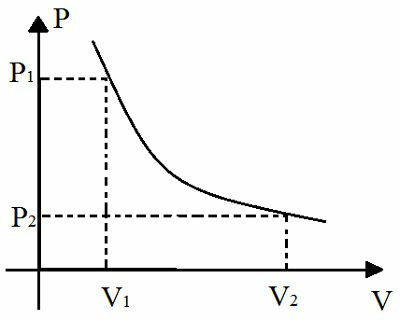
กราฟนี้แสดงความสัมพันธ์ระหว่างการเปลี่ยนแปลงความดันและการเปลี่ยนแปลงของอุณหภูมิระหว่างการเปลี่ยนแปลงอุณหภูมิด้วยความร้อน
การแสดงภาพกราฟิกของการเปลี่ยนแปลงอุณหภูมิแบบไอโซเทอร์มอลคือไฮเปอร์โบลา ยิ่งสินค้ามีขนาดใหญ่ V ของการแปลงนี้ ยิ่งไฮเปอร์โบลานี้อยู่ห่างจากแกนของกราฟมากเท่าใด ชื่อที่กำหนดให้กับเส้นโค้งนี้ที่แสดงในกราฟคือ ไอโซเทอร์ม.
โดย Mariane Mendes
จบฟิสิกส์
คุณต้องการอ้างอิงข้อความนี้ในโรงเรียนหรืองานวิชาการหรือไม่ ดู:
เตยเซร่า, มารีแอน เมนเดส. "การเปลี่ยนแปลงอุณหภูมิความร้อนคืออะไร"; โรงเรียนบราซิล. มีจำหน่ายใน: https://brasilescola.uol.com.br/o-que-e/fisica/o-que-e-transformacao-isotermica.htm. เข้าถึงเมื่อ 28 มิถุนายน 2021.