สารละลายคือส่วนผสมที่เป็นเนื้อเดียวกันของสารตั้งแต่สองชนิดขึ้นไป. เช่น สารละลายเกลือ (ตัวถูกละลาย) ที่ละลายในน้ำ (ตัวทำละลาย)

โดยเฉพาะอย่างยิ่งในห้องปฏิบัติการเคมีและอุตสาหกรรม กระบวนการนี้มีความสำคัญมาก เนื่องจากนักเคมีจำเป็นต้องเตรียมสารละลายที่มีความเข้มข้นที่ทราบ นอกจากนี้ ในกิจกรรมการทดลอง จะใช้สารละลายที่มีความเข้มข้นต่ำมาก ดังนั้นตัวอย่างของสารละลายเข้มข้นจึงถูกเจือจางจนถึงความเข้มข้นที่ต้องการ
ในแต่ละวัน เราดำเนินกระบวนการเจือจางสารละลายหลายครั้งโดยไม่รู้ตัว ตัวอย่างเช่น บรรจุภัณฑ์ของผลิตภัณฑ์ทำความสะอาดและสุขอนามัยในครัวเรือน เช่น ยาฆ่าเชื้อ แนะนำให้เจือจางก่อนใช้ ผู้ผลิตบางรายแนะนำบนฉลากผลิตภัณฑ์ว่าต้องเจือจางด้วยน้ำในสัดส่วน 1 ถึง 3 นั่นคือต้องเติมน้ำ 3 ส่วนสำหรับผลิตภัณฑ์แต่ละส่วน วิธีนี้ทำได้เนื่องจากผลิตภัณฑ์มีความเข้มข้นและแข็งแรงมาก และสามารถทำลายสถานที่ที่จะทาได้หากไม่เจือจางอย่างถูกวิธี ในทางกลับกัน ถ้าคุณเจือจางมากกว่าที่ควร คุณอาจจะเสียเงินเพราะผลิตภัณฑ์จะไม่บรรลุผลตามที่ต้องการ

อีกตัวอย่างหนึ่งคือเมื่อเราทำน้ำผลไม้ ฉลากน้ำผลไม้เข้มข้นจำนวนมากระบุว่าควรเจือจางน้ำผลไม้หนึ่งแก้วหรือผสมกับน้ำ 5 แก้ว ดังนั้นน้ำผลไม้จึง "อ่อนลง" นั่นคือมีความเข้มข้นน้อยลง
อย่าเพิ่งหยุด... มีมากขึ้นหลังจากโฆษณา ;)
ลองนึกภาพว่าคุณเจือจางน้ำผลไม้ดังกล่าวในน้ำ 3 ลิตร ถ้าความเข้มข้นของน้ำผลไม้เริ่มต้นคือ 40 กรัม/ลิตร แสดงว่ามีมวล 40 กรัมสำหรับตัวทำละลายแต่ละลิตร แต่เนื่องจากเราจะมี 3 ลิตร มวลจะถูกหารด้วย 3 จากนั้นความเข้มข้นจะอยู่ที่ประมาณ 13, 33 กรัม/ลิตร หรือ 13 กรัมสำหรับสารละลายแต่ละลิตร อย่างไรก็ตาม ในสารละลายทั้งหมด มวลของตัวถูกละลาย 40g ยังคงอยู่
การคำนวณความเข้มข้นใหม่นี้สามารถทำได้ดังนี้:
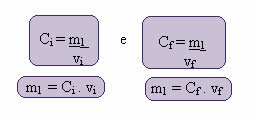
โดยที่ดัชนี i และ f แทนค่าเริ่มต้นและค่าสุดท้ายตามลำดับ เนื่องจากค่าของ m1 ไม่เปลี่ยนแปลง เราจึงทำให้สมการเท่ากันได้:
คผม. วีผม = Cฉ. วีฉ
การแทนที่ค่าที่เรามีตามตัวอย่างก่อนหน้านี้ ให้สังเกตว่า:
วิธีแก้ปัญหาเบื้องต้น:
คผม: 40g/L
m1: 40g
วีผม: 1L
ทางออกสุดท้าย:
คฉ: ?
m1: 40g
วีฉ: 3L
คผม. วีผม = Cฉ. วีฉ
(40 กรัม/ลิตร) (1 ลิตร) = Cฉ. 3L
คฉ = 40 กรัม/ลิตร
3
คฉ = 13.333 ก./ลิตร
เหตุผลเดียวกันนี้ใช้ได้กับความเข้มข้นของโมลาร์ (M) และเปอร์เซ็นต์โดยมวลของตัวถูกละลายหรือไทเทอร์ (T):
เอ็มผม. วีผม = เอ็มฉ. วีฉ และ ตู่ผม. วีผม = Tฉ. วีฉ
โดย เจนนิเฟอร์ โฟกาซา
จบเคมี
ทีมโรงเรียนบราซิล
คุณต้องการอ้างอิงข้อความนี้ในโรงเรียนหรืองานวิชาการหรือไม่ ดู:
โฟกาซ่า, เจนนิเฟอร์ โรชา วาร์กัส "การเจือจางของสารละลาย"; โรงเรียนบราซิล. มีจำหน่ายใน: https://brasilescola.uol.com.br/quimica/diluicao-solucoes.htm. เข้าถึงเมื่อ 27 มิถุนายน 2021.