ทุกเซลล์เป็นอุปกรณ์ที่มีปฏิกิริยาลดการเกิดออกซิเดชันที่เกิดขึ้นเองซึ่งสร้างกระแสไฟฟ้า ซึ่งในทางกลับกัน จะใช้เพื่อทำให้อุปกรณ์บางอย่างทำงานได้
อุปกรณ์เหล่านี้ได้ชื่อมาจากแบตเตอรี่ก้อนแรกที่สร้างขึ้นโดย Alessandro ย้อนกลับไปในปี ค.ศ. 1800 เกิดเป็นแผ่นสังกะสีและทองแดงคั่นด้วยสำลีแช่ในed น้ำเค็ม. ชุดนี้วางสลับกันไปมา ซ้อน แผ่นและขึ้นรูปเป็นเสาขนาดใหญ่ a. เป็นอย่างไรบ้าง แบตเตอรี่ ของแผ่นดิสก์เริ่มถูกเรียกตามชื่อนั้น

แบตเตอรี่ประกอบด้วยอิเล็กโทรดสองขั้วและอิเล็กโทรไลต์. อิเล็กโทรดบวกเรียกว่า a แคโทด และนี่คือปฏิกิริยาของ ลด. อิเล็กโทรดลบคือ ขั้วบวก และนี่คือปฏิกิริยาของ ออกซิเดชัน. อิเล็กโทรไลต์เรียกอีกอย่างว่า สะพานเกลือ และเป็นสารละลายนำไอออน
เพื่อให้คุณเข้าใจว่าสิ่งนี้สร้างกระแสไฟฟ้าได้อย่างไร โปรดดูกรณีของแบตเตอรี่ก้อนแรก กองของแดเนียลซึ่งมีภาชนะที่มีสารละลายคอปเปอร์ซัลเฟต (CuSO4(aq)) และจุ่มลงในสารละลายนั้นเป็นแผ่นทองแดง ในภาชนะอื่นที่แยกจากกัน มีสารละลายของซิงค์ซัลเฟต (ZnSO4(aq)) และแผ่นสังกะสีแบบจุ่ม สารละลายทั้งสองเชื่อมต่อกันด้วยสะพานเกลือ ซึ่งเป็นหลอดแก้วที่มีสารละลายโพแทสเซียมซัลเฟต (K
2เท่านั้น4(aq)) ด้วยใยแก้วที่ปลาย ในที่สุด เพลตทั้งสองถูกเชื่อมต่อกันด้วยวงจรภายนอกโดยมีหลอดไฟซึ่งแสงจะบ่งบอกถึงเส้นทางของกระแสไฟฟ้า: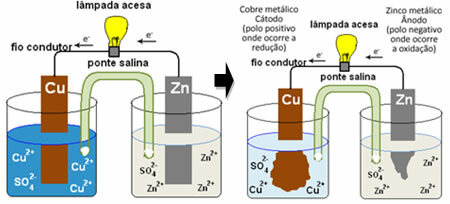
สิ่งที่เกิดขึ้นคือสังกะสีมีแนวโน้มที่จะออกซิไดซ์มากขึ้น กล่าวคือ สูญเสียอิเล็กตรอน ดังนั้นสังกะสีโลหะของใบมีดจึงทำงานเป็นอิเล็กโทรดขั้วลบ ซึ่งเป็นขั้วบวกที่เกิดออกซิเดชัน: สังกะสี( ส) ↔ Zn2+(ที่นี่) + 2 และ-. อิเล็กตรอนที่สังกะสีสูญเสียไปจะถูกขนส่งโดยวงจรภายนอกไปยังทองแดง ทำให้เกิดกระแสไฟฟ้าที่เปิดหลอดไฟ ไอออนของทองแดงในสารละลายรับอิเล็กตรอน (ลด) และเปลี่ยนเป็นทองแดงที่เป็นโลหะซึ่งสะสมอยู่บนแผ่นทองแดง ซึ่งหมายความว่านี่คืออิเล็กโทรดขั้วบวก แคโทด ซึ่งเกิดการรีดักชัน: ตูด2+(ที่นี่) + 2 และ- ↔ ตูด( ส).
อย่าเพิ่งหยุด... มีมากขึ้นหลังจากโฆษณา ;)
แบตเตอรี่ในปัจจุบันมีหลักการทำงานแบบเดียวกันนี้ โดยโลหะชิ้นหนึ่งจะบริจาคอิเล็กตรอนให้อีกตัวหนึ่ง ผ่านสารละลายที่เป็นสื่อกระแสไฟฟ้า และผลิตกระแสไฟฟ้า ข้อแตกต่างคือแบตเตอรี่ที่ใช้ในปัจจุบันจะแห้ง เพราะไม่ได้ใช้สารละลายของเหลวเป็นอิเล็กโทรไลต์ เหมือนในแบตเตอรี่ของแดเนียล
ปัจจุบันมีแบตเตอรี่หลากหลายประเภทที่จำหน่ายในเชิงพาณิชย์ ในหมู่พวกเขาที่พบมากที่สุดคือ เซลล์กรด (จากLeclanche) และแบตเตอรี่อัลคาไลน์.
ทั้งสองมีสังกะสีเป็นขั้วลบ อีกด้านเป็นขั้วบวกมีแท่งกราไฟท์ติดตั้งอยู่ตรงกลางของเสาเข็มล้อมรอบด้วยแมงกานีสไดออกไซด์ (MnO2) ผงถ่าน (C) และแป้งเปียก ความแตกต่างคือ ในกองกรด แอมโมเนียมคลอไรด์ (NH) ถูกใช้ในแป้งเปียก4Cl) และสังกะสีคลอไรด์ (ZnCl2) - เกลือที่มีลักษณะเป็นกรด - นอกเหนือจากน้ำ (H2อ.) ในแบตเตอรี่อัลคาไลน์จะใช้โพแทสเซียมไฮดรอกไซด์ (KOH) ซึ่งเป็นเบส

แบตเตอรี่ Leclanché เหมาะที่สุดสำหรับอุปกรณ์ที่ต้องการแสงและการปล่อยประจุอย่างต่อเนื่อง เช่น รีโมทคอนโทรล นาฬิกาแขวนผนัง วิทยุแบบพกพา และของเล่น ในขณะที่แบตเตอรี่อัลคาไลน์มีพลังงานมากกว่าแบตเตอรี่ขนาดเดียวกันทั่วไป 50 ถึง 100% ซึ่งแนะนำให้ใช้กับอุปกรณ์ที่ ต้องการการดาวน์โหลดที่เร็วและเข้มข้นกว่า เช่น วิทยุ เครื่องเล่น CD/DVD เครื่องเล่น MP3 แบบพกพา ไฟฉาย กล้องดิจิตอล เป็นต้น

ค้นหาเพิ่มเติมเกี่ยวกับอิเล็กโทรไลต์และอิเล็กโทรดที่ใช้ในแบตเตอรี่เหล่านี้และแบตเตอรี่ประเภทอื่นๆ ด้วย ส่วนอุปกรณ์ประเภทไหนที่แนะนำมากที่สุด อ่านบทความที่เกี่ยวข้องเพิ่มเติม ร้อง
โดย เจนนิเฟอร์ โฟกาซา
จบเคมี


